テーマのリスト
テーマをクリックするとテーマの詳細に移動します。
- 生物産業に利用可能なエネルギー生成系と物質輸送体の研究とその応用:細菌における脱炭酸に共役したエネルギー生成系の研究
- 糸状菌の産生する界面活性タンパク質を介した固液界面酵素反応:新しい固体高分子分解機構の解明とその応用
- 微生物のストレス応答シグナル伝達系の研究とその応用
- 黄色ブドウ状球菌の血球崩壊毒素に関する研究
- ルーメン細菌Selenomonas ruminantiumの表層構造の機能とゲノム解析
- バクテリオファージとその関連物質に関する研究
- キシラン分解細菌Paenibacillus sp. W-61のキシラン分解機構に関する遺伝子レベルでの解析
- 細菌の生産する生分解性プラスチック(ポリ乳酸)分解機構に関する分子レベルでの解析
- バクテリアルセルロース生産時に副産物として産生される多糖(アセタン、レバン)の酵素分解に関する研究
- 粘液細菌(Myxococcus sp.)の分離法の確立と分離菌株の分譲
テーマの詳細
生物産業に利用可能なエネルギー生成系と物質輸送体の研究とその応用:
細菌における脱炭酸に共役したエネルギー生成系の研究
微生物を利用した大規模物質生産(発酵)には、例えば汎用化成品・食品に該当する有機酸・アミノ酸などの一次代謝産物や、抗生物質などの二次代謝産物の生産があります。
これらは、数百トン規模の大型発酵タンクを用いて生産されるものも多く、世界規模では単品で年産100万トンを越える物質も多数あります。
発酵においては一般に目的物質生産のために極端な代謝制御を行う。
過度な代謝制御は、逆にエネルギー供給代謝系の制御を困難とし、菌体内エネルギーレベル(ATPなど)が低下して、生産物収量のさらなる改善の限定要因となることが多く、課題となっています。
これまで、わが国の発酵産業は、細胞内代謝の機能改変・強化による増産を試み成功を収めて、世界をリードしてきましたが、それらの手法も現在では限界に達しています。
すなわち、基質の輸送・産物の排出が律速となり、今まで以上の生産性向上は見込めないことから、1) 基質の輸送および産物の排出機能の根本的強化・改変による生産性の限界打破が課題となっています。
しかし、輸送体を制御して物質生産を行うテクノロジーは未だ実現していません。
我々は、方策の一つとして、輸送・排出過程でエネルギーを消費せずにエネルギーを生産しつつ物質生産を高速且つ高効率に行う代謝系の探索を行い、
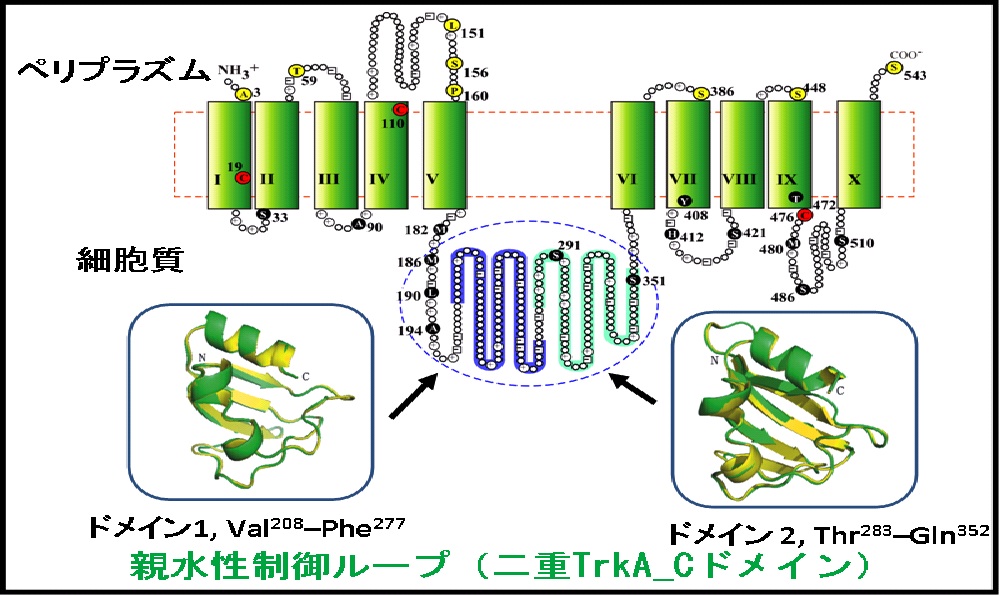
アスパラギン酸(Asp):アラニン(Ala)交換系やグルタミン酸(Glu):(GABA)交換系を見出し、生化学的解析から産業応用までを行っています。2,3) 現在、産業界と連携して物質生産に向けた輸送体の研究を展開しています。
図1物質生産の輸送体制御による改変
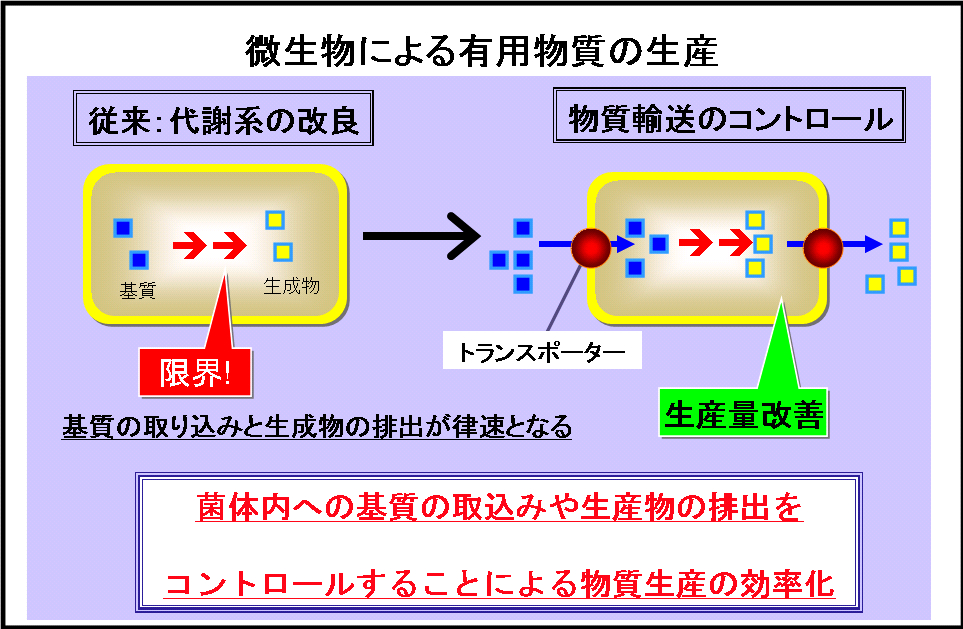
図2アスパラギン酸脱炭酸反応によるATP生成
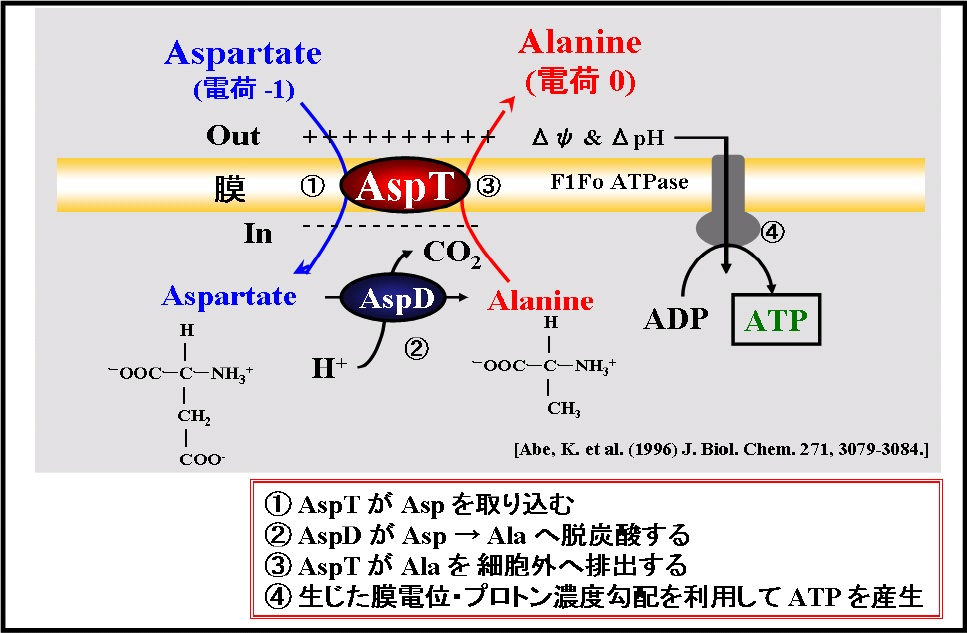
図3Aspartate:Alanine交換輸送体(AspT)の二次構造
1) 2) Nanatani K. et al. J. Bacteriol., 89:7089-7097 (2007)
2) 阿部敬悦, バイオサイエンスとインダストリー 62, 651-656 (2007)
3) 七谷 圭, 阿部敬悦 バイオサイエンスとインダストリー 66:442-446 (2008)
4) Nanatani K. et al., J. Bacteriol. 171:2122-2132 (2009)
糸状菌の産生する界面活性タンパク質を介した固液界面酵素反応:
新しい固体高分子分解機構の解明とその応用
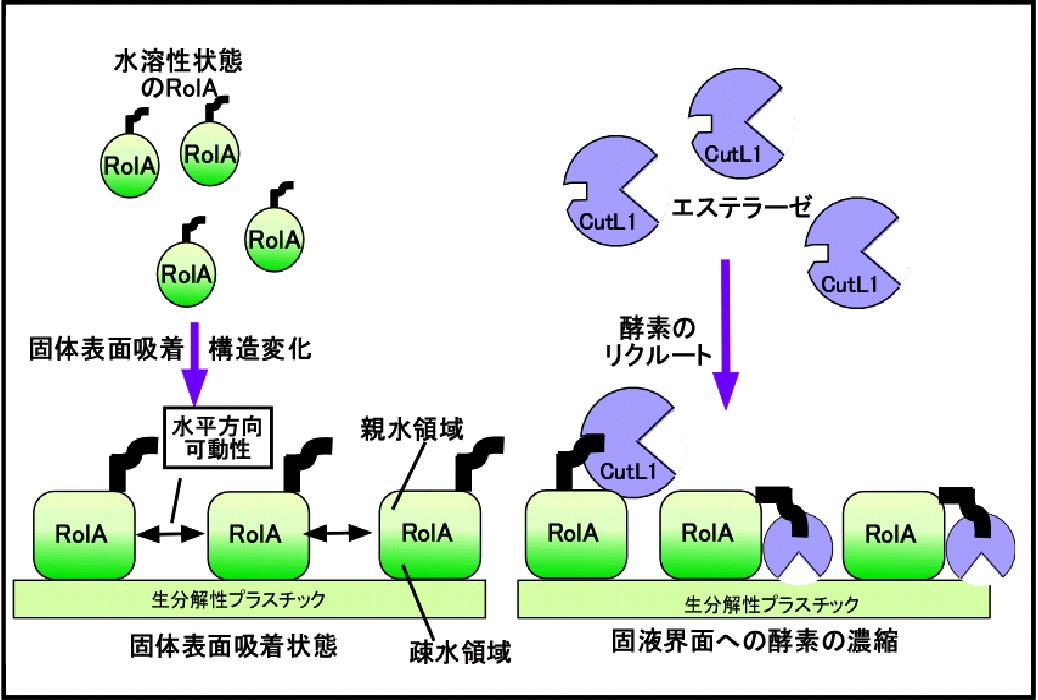
糸状菌は天延の個体高分子分解と物質循環において重要な役割を担っています。 我々は糸状菌が固体高分子を分解する際に、分解酵素の他にも多様な界面活性タンパク質を産生し、界面活性タンパク質が固体表面で足場となって分解酵素を固液界面にリクルートして分解促進を行う、新しい機構を発見しました。
現在、界面活性タンパク質の生化学的解析、新たな界面活性タンパク質ー分解酵素の組み合わせ探索を通じ、生体高分子酵素分解の基礎研究から多様な応用研究を展開しています。
日本は麹菌を中心とする世界最大の糸状菌固体培養インフラを有していることから、ゲノム科学・分子生物学・生物情報科学を活用して積極的に異分野との融合を図ることで、大規模生産インフラを生かした日本オリジナルの新規バイオプロセス・新規グリーンケミストリー産業を育成することが期待されます。
1)阿部敬悦ら、STN出版、「ゲノミクスとプロテオミクスの新展開ー生物情報の解析と応用」pp. 1001-1008 (2004)
2)阿部敬悦ら、特願2002-308884
3)阿部敬悦、五味勝也、グリーンプらジャーナル 19:16-22 (2005)
4)Maeda H et. al.,Appl. MIcrobiol. Biotech. 67:778-788(2005)
5)Takahashi T et al., Mol. Microbiol. 57:1780-1798 (2005)
6)Ohtani S. et al., Appl. Environ. Microbiol. 72:2407-2413 (2006)
7)Abe K et al., Novel Industrial Application of Aspergillus oryzae Genomics.Aspergillus: Molecular Biology and Genomics. Chapter 10 pp. 199-227, Machida M and Gomi K. edts., Caisster Academic Press (2009)
微生物のストレス応答シグナル伝達系の研究とその応用
農薬・医薬産業においては、研究開発時間単位の創薬効率が低下してきており、大きな問題になっています。
感染症薬剤開発もその例外ではありません。我々は、微生物ゲノム科学技術・分子生物学・生物情報科学技術・合成化学・工学技術を融合して、継続的に抗菌剤を創出可能な新規創薬パイプライを開発し、農薬・医薬産業に貢献します。
糸状菌には、農業生産の脅威となる植物感染菌、医療上問題となるヒト感染菌、産業上有用な菌などが含まれる。
近年、植物感染菌およびヒト感染菌被害は増加傾向にあり、農薬用および医療用抗真菌剤の需要が増加している。
しかし、開発時間当たりの候補化合物ヒット数は減少傾向にあり、抗真菌剤を連続的に創出するためには、開発プロセスの効率化が常に求められています。
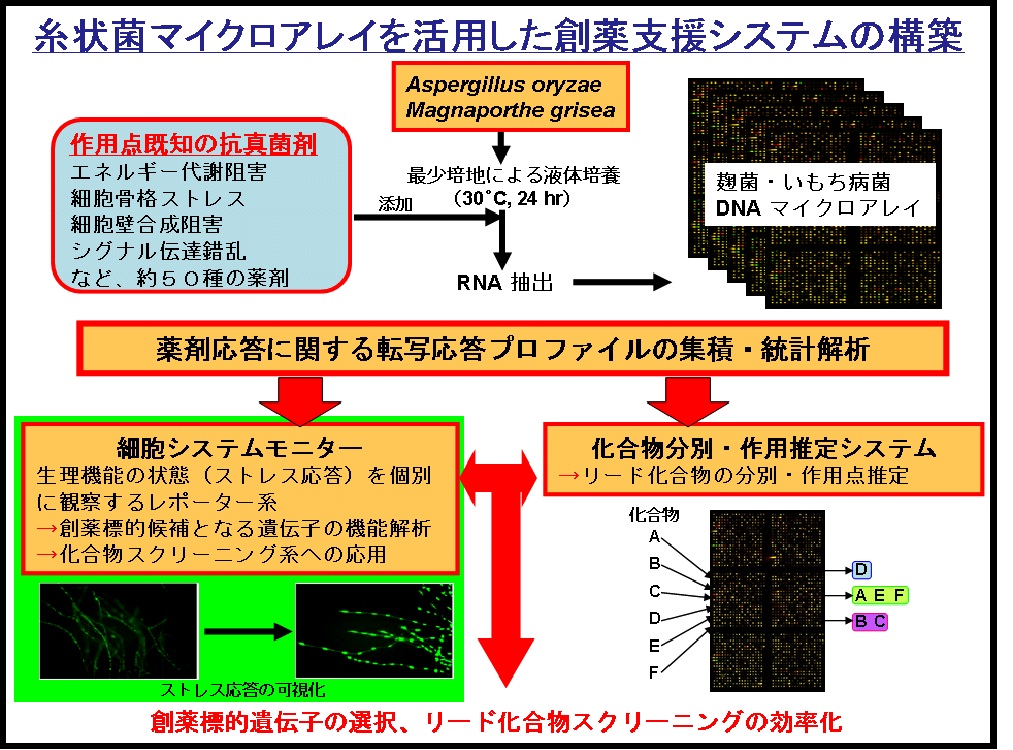
我々はこの課題に対し、Aspergillus属糸状菌とイネいもち病菌Magnaporthe griseaを対象に、糸状菌ゲノム情報を活用して、候補化合物探索用の新規パイプラインの構築を行っています。
麹菌Aspergillus oryzaeは、我が国の伝統的発酵産業に用いられている産業微生物であり、日本単独でゲノム解析が行われた初めての真核微生物であることから、ゲノム科学情報、DNAマイクロアレイ等の解析ツールと生物的リソースの面で高い優位性を有します。
また、病原性糸状菌Aspergillus fumigatusと近縁であり、両菌のゲノム情報には多くの類似性が認められています。さらに、麹菌は、他の糸状菌と比較して、薬剤代謝に関与し得る遺伝子を多数保有し、複数の薬剤に対して高い抵抗性を示すことが知られています。
これらのことから、麹菌をベースとした薬剤開発を行うことにより、薬剤抵抗性に強く、広範な抗菌スペクトルを示す有用な抗真菌剤の創出が期待できます。
一方、M. griseaは、付着器形成等の特別な形態形成による植物感染プロセスを示し、植物感染モデル菌となっている。
M. griseaにおいてもゲノム情報・生物的リソースが整備されており、新たにDNAマイクロアレイを作製することで探索パイプライン構築に組み込みが可能となりました。
本研究では、新規パイプライン(図参照)を構成する、様々な基準抗真菌剤に対する糸状菌の網羅的な転写応答プロファイル解析から創薬標的候補遺伝子の機能解析と候補化合物の系統的分別探索に有効な、
1)細胞システム毎(エネルギー系、細胞膜生合成系、細胞壁系、細胞骨格系、シグナル伝達系等)のレポーターアッセイ系、2)化合物転写応答データベースの構築を行って、本システムを活用した化合物探索を行っています。
特に糸状菌のストレス応答シグナル伝達系の研究を基礎に、シグナル伝達系への作動薬剤を探索しています。本研究開発は、生研センター異分野融合事業およびNEDO知的基盤創成事業の支援によって行われました。
図1
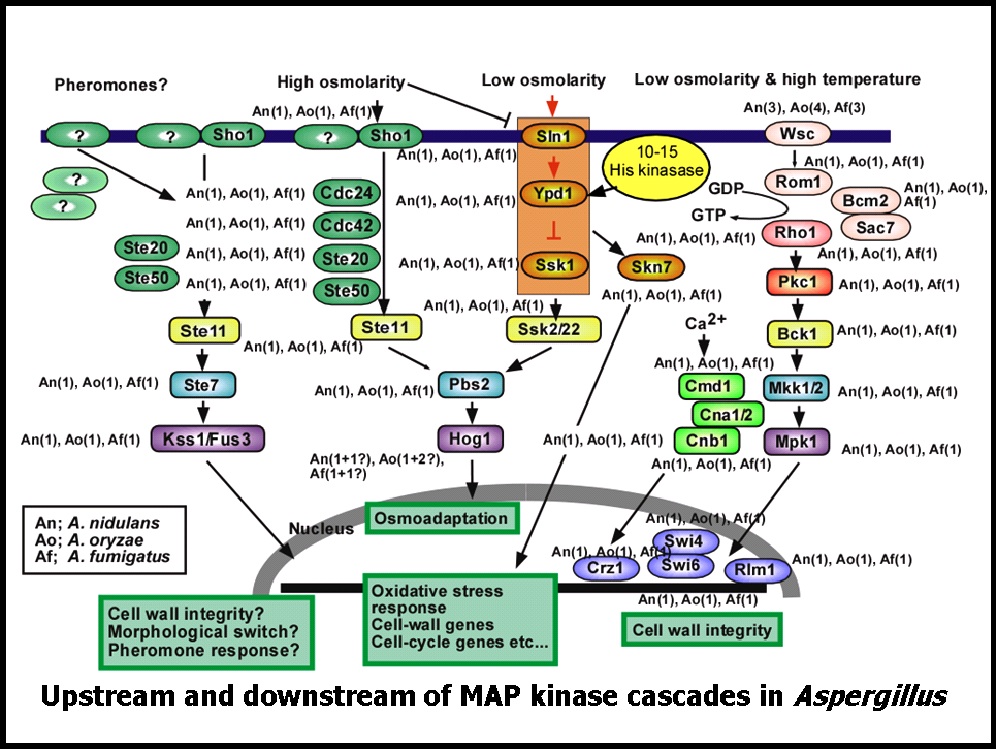
図2
1) Furukawa K. et al. Appl. Environ. Microbiol., 68:5304-5310 (2002)
2) Mizutani, O. et al. Eukaryot Cell , 3:1036-1048. (2004)
3) Furukawa K. et al., , Mol. Microbiol., 56:1246-1261 (2005)
4) Fujioka, T., et al.(2007) Eukaryot Cell , 6:1497-1510.
5) Mizutani. O. et al. Biosci Biotechnol Biochem. 73:40-46 (2009)
6) Hagiwara D. et al., Fung. Genet. Biol 46:868-878 (2009)
7) Yoshimi A. et al., PloS ONE 8(1):e54893 (2013)
黄色ブドウ状球菌の血球崩壊毒素に関する研究
黄色ブドウ球菌は日和見感染による化膿性疾患や食中毒の原因菌であり、それらの症状はこの菌が生産する赤血球・白血球崩壊毒素やエンテロトキシンなどの多くの病原因子(いわゆる毒素)により引き起こされます。
これらのうち、血球の崩壊に2つの成分が関与する二成分性毒素の存在は1930年代から知られていましたが、その作用機構は不明でした。
本研究室では1993年から95年二かけて二成分性赤血球崩壊毒素γヘモリジン(Hlg)及びロイコシジン(Luk)の各成分の遺伝子のクローン化に成功して以来、二つの成分の組合せで標的となる血球細胞が決まること、二成分性血球崩壊毒素が細胞膜に穴を開ける膜孔形成毒素であることを発見し、国内・国外の研究者と共同でその作用機構を明らかにしてきました。
一方1997年にはウシ乳房炎由来株から新規二成分性毒素(LukMFPV’)を発見しました。
現在までに、黄色ブドウ球菌の二成分性膜孔形成毒素はHlg/Luk、LukMFPV’に加え、市中獲得型MRSA(CA-MRSA)の多くが保有するPanton-Valentine型ロイコシジン(PVL)や、臨床分離株から見いだされるLukEDなどが発見されています。
しかし、それらの毒素が菌の感染時にどの様な形で連携しながら作用しているのか、県有に対する特異性はどの様にして規定されているのかは不明です。
私たちは現在、感染を決定する毒素の構造や標的血球細胞の受容体の探索及び血球型の応答の解析を進めており、それらの成果を感染機構の理解及び新しい感染症治療につなげようとしています。
一方、1997年から2001年にかけてPVL遺伝子が複数のファージによって水平伝播されることを発見しました。
これまでファージによるPVL遺伝子の伝播と強毒株の出現、MRSAと病原株との関連も疫学と分子生物学の両面から研究を進めており、現在はファージの感染に関わるファージ側、宿主細菌側因子を探求しています。
(バクテリオファージの稿参照)
ルーメン細菌Selenomonas ruminantiumの表層構造の機能とゲノム解析
反芻動物の第1胃(ルーメン)には多くの原生生物や微生物が共生しています。
それらが連携して宿主が食べた植物細胞壁セルロースを消化分解して増殖し、揮発性脂肪酸(VFA)を生成します。
宿主動物はそれらの細胞及びVFAを栄養源として利用しているのです。
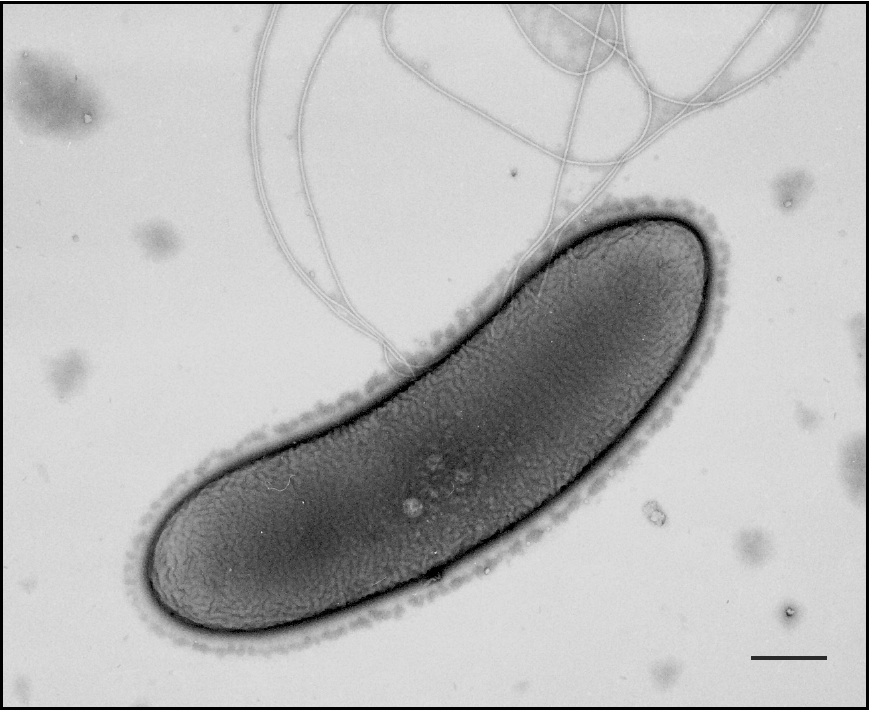 本研究室では1970年代から80年代初頭にかけて、これらのうちヒツジルーメンの代表的細菌であるグラム陰性細菌S. ruminantiumが細胞質膜や外膜にはアルケニルアシル型グリセロリン脂質(プラズマローゲン)を含み、細胞壁ペプチドグリカンにはカダベリン(ポリアミンの一種)が共有結合しているなど、大腸菌の細胞表層には存在しない成分・構造を持っていることを見いだしていらい、その特徴的な表層構造に関する研究を進めてきました。
特に細胞壁結合カダベリンの代謝経路に関して、その鍵酵素であるリジン脱炭酸酵素とその分解に関与するアンチザイムを細菌では初めて発見し、また外膜を有するにもかかわらず16Sリボゾームはグラム陽性型の予特徴を示すます。
この様にS. ruminantiumは、畜産の重要菌であり、ユニークな細胞表層構造と代謝系をもつ分類学的にも興味ある細菌です。
現在、ペプチドグリカン結合ポリアミンの機能と細胞表層蛋白質との相互作用、ポリアミンの生合成酵素とその遺伝子の研究を展開しています。
一方2007年より(独)製品評価技術基盤機構(NITE)と共同でゲノム解析が進めています。
本研究室では1970年代から80年代初頭にかけて、これらのうちヒツジルーメンの代表的細菌であるグラム陰性細菌S. ruminantiumが細胞質膜や外膜にはアルケニルアシル型グリセロリン脂質(プラズマローゲン)を含み、細胞壁ペプチドグリカンにはカダベリン(ポリアミンの一種)が共有結合しているなど、大腸菌の細胞表層には存在しない成分・構造を持っていることを見いだしていらい、その特徴的な表層構造に関する研究を進めてきました。
特に細胞壁結合カダベリンの代謝経路に関して、その鍵酵素であるリジン脱炭酸酵素とその分解に関与するアンチザイムを細菌では初めて発見し、また外膜を有するにもかかわらず16Sリボゾームはグラム陽性型の予特徴を示すます。
この様にS. ruminantiumは、畜産の重要菌であり、ユニークな細胞表層構造と代謝系をもつ分類学的にも興味ある細菌です。
現在、ペプチドグリカン結合ポリアミンの機能と細胞表層蛋白質との相互作用、ポリアミンの生合成酵素とその遺伝子の研究を展開しています。
一方2007年より(独)製品評価技術基盤機構(NITE)と共同でゲノム解析が進めています。
バクテリオファージとその関連物質に関する研究
バクテリアのウイルスであるバクテリオファージは細菌の天敵としてだけではなく、細菌がそれを利用している側面があります。
溶原化ファージが宿主のDNAを持ち込む形質導入はよく知られていますが、細菌のゲノム解析が進むにつれ、ファージが酵素遺伝子や毒素遺伝子などを持ち運び、溶原化した細菌の形質を変化させるファージ変換という仕組みが、細菌が新しい形質を獲得する際に関わっていることが分かってきました。
1997年の発見以来研究を進めている黄色ブドウ球菌のPVL型毒素遺伝子保有ファージ群は、ブドウ球菌に感染溶原化することで新たな病原因子産生能を付与します。
現在、これまでブドウ球菌ファージとして初めてそのゲノムを明らかにし、これら二成分性毒素遺伝子を保有するファージの宿主への感染機構の解析を進め、環境中でどの様に遺伝子を伝播し、強毒菌が生まれるのかを明らかにすることを目指しています。
また、細菌を用いている発酵工業においてファージ感染は重大な問題です。
細菌が産生する菌体外糖ポリマーやアミノ酸ポリマーは菌がファージから身を守るバリアとして働いていますが、納豆菌に感染するファージは納豆菌の防御壁であるポリγグルタミン酸(PGA)を分解する酵素の遺伝子を持ち歩いており、うまく隙間をくぐり抜けて感染に成功したファージは宿主菌に娘ファージと共にPGA分解酵素を作らせることで、納豆菌集団の防御壁を破ります。
これが「糸切れ」です。私たちは2006年より食品総合研究所と連携して本ファージの解析に取り組み、現在そのゲノムの解析を進めています。
一方、細菌の中には溶原化したファージを競合する近縁菌と対抗する手段として用いているものがあります。
1980年に本研究室で植物病原菌Pectobacterium carotovorum (Erwinia carotovora)から発見された高分子量バクテリオシンであるcarotovoricin(Ctv)はファージ尾部状の構造を有し、マイトマイシンや紫外線などにより産生が誘発されます。
これまでにその詳細な構造を明らかにすると共にその産生に関わる遺伝子群の全貌を明らかにして、本菌がバクテリオファージの尾部遺伝子群と溶菌遺伝子群のみを保持しすることを見いだし、これらの遺伝子群をSOS応答で誘発する因子を特定してきました。
現在Ctvは多くのPectobacterium carotovorumが保有しているが、それぞれ感受性菌のスペクトルが異なっているメカニズムの解析を進めています。
キシラン分解細菌Paenibacillus sp. W-61のキシラン分解機構に関する遺伝子レベルでの解析
キシラナーゼ研究の経緯
昨今の石油危機を経て、近年はエコカー減税やエコポイント制度が導入されるなど、日本の環境問題に対する取り組みは刻々と変化しています。
そんな時代が来る 20 年も前、私たちの研究室では「未利用のバイオマス資源から、何か高い付加価値を持つものを作れないだろうか ?」と考えていました。
そして宮城県をはじめ東北地方が有数の米所であるという立地を活かし、稲作の過程で生じる稲わらやもみ殻の有効に利用を目的として、当研究はスタートしました。
研究の最終目的と研究内容
稲わらやもみ殻の中には、キシランと呼ばれる多糖が含まれており、分解することによって得られるキシロオリゴ糖は、高い整腸作用を持つことが報告されています。
しかし、キシランは化学的、物理的な分解が難しく、微生物や酵素を利用した生物学的な分解が有効です。
そこで当研究室では、キシラン分解細菌 (Paenibacillus sp. W-61)とその産生酵素 (キシラナーゼ) の研究を行うことによって、キシランの効率的な分解を試みています。
1990 年、当研究室の Dung が、キシラン分解細菌を土壌中より単離・同定したことに始まり (1)、本菌の産生する 5 種類のキシラナーゼの酵素学的な諸性質が次々と明らかになりました (2, 3, 4, 5, 6)。
さらに最近は、キシラナーゼの分泌を助けるタンパク質の研究 (7) を行い、酵素の性質だけではなく、菌が酵素を産生する力をどうすれば高めることができるかにも注目しています。
そして、現在、これらの 5 種類のキシラナーゼがどの様に協調的に働けば、キシラン分解細菌は最も効率よくキシランを分解するのかを調べている所です。
今後、複数の酵素や細菌を組み合わせることによって効率的な分解が生じる相乗効果は、どのようなメカニズムによって生じるのかを調べる予定です。
(1) Nguyen, V. D., Y. Kamio, N. Abe, J. Kaneko, and K. Izaki. 1991. Purification and properties of β-1, 4-xylanase from Aeromonas caviae W-61. Appl. Environ. Microbiol. 57:445-449.
(2) Nguyen, V. D., Y. Kamio, N. Abe, J. Kaneko, and K. Izaki. 1993. Purification and properties of β-1, 4-xylanases 2 and 3 from Aeromonas caviae W-61. Biosci. Biotechnol. Biochem. 57:1708-1712.
(3) Okai, N., M. Fukasaku, J. Kaneko, T. Tomita, K. Muramoto, and Y. Kamio. 1998. Molecular properties and activity of carboxyl-terminal truncated form of xylanase 3 from Aeromonas caviae W-61. Biosci. Biotechnol. Biochem. 62:1560-1567.
(4) Roy, N., N. Okai, T. Tomita, K. Muramoto, and Y. Kamio. 2000. Purification and some properties of high-molecular-weight xylanases, the xylanase4 and 5 of Aeromonas caviae W-61. Biosci. Biotechnol. Biochem. 64:408-413.
(5) Ito, Y., T. Tomita, N. Roy, A. Nakano, N. Sugawara-Tomita, S. Watanabe, N. Okai, N. Abe, and Y. Kamio. 2003. Cloning, expression, and cell surface localization of Paenibacillus sp. strain W-61 xylanase 5, a multidomain xylanase. Appl. Environ. Microbiol. 69:6969-6978.
(6) Watanabe, S., V. D. Nguyen, J. Kaneko, Y. Kamio, and S. Yoshida. 2008. Cloning, expression, and transglycosylation reaction of Paenibacillus sp. strain W-61 Xylanase 1. Biosci. Biotechnol. Biochem. 72:951-958.
(7) Fukuda, M., S. Watanabe, J. Kaneko, Y. Itoh, Y. Kamio. 2009. The membrane lipoprotein LppX of Paenibacillus sp. strain W-61 serves as a molecular chaperone for xylanase of glycoside hydrolase family 11 during secretion across the cytoplasmic membrane. J. Bacteriol. 191:1641-1649.
細菌の生産する生分解性プラスチック(ポリ乳酸)分解機構に関する分子レベルでの解析
準備中です。
バクテリアルセルロース生産時に副産物として産生される多糖(アセタン、レバン)の酵素分解に関する研究
準備中です。
粘液細菌(Myxococcus sp.)の分離法の確立と分離菌株の分譲
準備中です。