1. キュウリモザイクウイルス感染応答におけるシグナル伝達機構の解明
【研究の概略】 全ゲノム情報が明らかになっているシロイヌナズナ(Arabidopsis thaliana)はCMV の宿主のひとつである。CMV 系統とシロイヌナズナ183 エコタイプを用いて、CMV 感染に対するシロイヌナズナの応答を解析したところ、エコタイプC24
はCMV 黄斑系統[CMV(Y)] に対して過敏感反応抵抗性(HR)を示すが、CMV B2 系統[CMV(B2)] に対しては罹病性であることを見いだした。そのCMV
2 系統間のキメラウイルスを用いて、HR を決定しているウイルス遺伝子(非病原性遺伝子)を解析したところ、CMV の外被タンパク質遺伝子が非病原性遺伝子として機能していることが明らかになった。また、CMV(Y)に罹病性であるエコタイプCol
と抵抗性であるC24 の交配後代を用いて遺伝分析を行ったところ、CMV(Y)に対するHR は第5 染色体のMRC-J 領域に存在する単一優性遺伝子により支配されていることが明らかとなり、この遺伝子をCMV(Y)抵抗性遺伝子RCY1 [Resistance to CMV(Y)]と命名した。ポジショナルクローニングの結果、RCY1 はCC-NBS-LRR ドメインを持つ分子量約104kDa のタンパク質をコードしていていることが明らかになった。
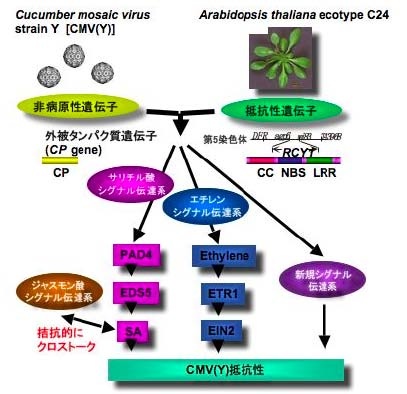
次に、RCY1 の下流に存在するシグナル伝達系について解析を行った。シロイヌナズナでは各種シグナル伝達系に異常をきたした変異体が単離されていることから、各変異体をC24
と交配することによりRCY1 をもつ変異体シリーズを作成し、CMV(Y)に対する応答を解析した。その結果、(1)RCY1 を介したCMV(Y) 抵抗性には、サリチル酸(SA)とエチレンを介したシグナル伝達系が関与している、(2)完全なCMV 抵抗性を発現させるためには、それらのシグナル伝達系以外に新規な未知のシグナル伝達系が必要である、(3)CMV(Y)抵抗性においてSA シグナル伝達系とジャスモン酸を介したシグナル伝達系の間では負のクロストークが存在している、(4)CMV(Y)抵抗性には、NDR1( 膜関連タンパク質)やEDS1( リパーゼ様タンパク質)のように、一般に抵抗性遺伝子の下流で機能していることが報告されている遺伝子は必要とされない、(5)葉緑体における脂質代謝を介したシグナル伝達系がCMV に対する基本的抵抗性に関与しているなどの新しい知見が明らかになった。
以上の結果から、図に示すように、C24 におけるCMV(Y)抵抗性は、ウイルスの外被タンパク質遺伝子と植物の抵抗性遺伝子RCY1 により支配されており、その下流にはSA とエチレンを介したシグナル伝達系に加え、新規なシグナル伝達系が関与や、シグナル伝達系間のクロストークが存在しているものと考えられた。

図 シロイヌナズナエコタイプC24におけるCMV(Y)抵抗性シグナル伝達系
【原著論文リスト】 (2000 - 2012 年)
Lapin, D., Meyer, R.C., Takahashi, H. and van den Ackerveken, G. (2012)
Broad resistance of Arabidopsis C24 to downy mildew is mediated by different
combinations of isolate-specific loci. New Phytologist (in press)
Takahashi, H., Shoji, H., Ando, S., Kanayama, Y., Kusano, T., Takeshita,
M., Suzuki, M. and Masuta, C. (2012) RCY1-mediated resistance to Cucumber mosaic virus is regulated by
LRR domain-mediated interaction with CMV(Y) following degradation of RCY1. Molecular
Plant-Microbe Interactions 25: 1171-1185.
Sagor, G.H.M., Takahashi, H., Niitsu, M., Takahashi, Y., Berberich, T.
and Kusano, T. (2012) Exogenous thermospermine has an activity to induce
a subset of the defense genes and restrict cucumber mosaic virus multiplication
in Arabidopsis thaliana. Plant
Cell Report 31: 1227–1232.
Takahashi, H., Kai, A., Yamashita, M., Ando, S., Sekine, K.-T., Kanayama,
Y. and Tomita, H. (2012) Cyclic nucleotide-gated ion channel-mediated cell
death may not be critical for R gene-conferred resistance to
Cucumber mosaic virus in Arabidopsis
thaliana. Physiological and Molecular Plant Pathology 79: 40-48.
Elsharkawy, M.M., Shimizu, M., Takahashi, H. and Hyakumachi, M. (2012)
Induction of systemic resistance against Cucumber mosaic virus by Penicillium
simplicissimum GP17-2 in Arabidopsis and tobacco. Plant Pathology 61: 964–976.
Elsharkawy, M.M., Shimizu, M., Takahashi, H. and Hyakumachi, M. (2012)
The plant growth-promoting fungus Fusarium equiseti and the arbuscular
mycorrhizal fungus Glomus
mosseae induce systemic resistance against Cucumber mosaic virus in cucumber plants. Plant and Soil (in press)(DOI 10.1007/s11104-012-1255-y)
Takenaka, S., Yamaguchi, K., Masunaka, A., Hase, S., Inoue, T. and Takahashi,
H. (2011) Implications of oligomeric forms of POD-1 and POD-2 proteins
isolated from cell walls of the biocontrol agent Pythium
oligandrum in relation to their ability to induce defense reactions in
tomato. Journal of Plant Physiology
168: 1972-1979.
Takahashi, H.,
Sekiguchi, H., Ito, T., Sasahara, M., Hatanaka, N. Ohba, A., Hase, S., Ando, S.
and Takenaka, S. (2011) Microbial community profiles in intercellular fluid of
rice and their variation during stages of growth. Journal of General Plant Pathology
77: 121-131.
Hong-Gu Kang, Chang-Sik Oh, Masanao Sato, Fumiaki Katagiri, Jane Glazebrook, Hideki Takahashi, Gregory Martin and Daniel F. Klessig (2010) CRT1, a new player in R (resistance) gene-mediated immunity, implicates endosomes in defense signaling. Plant Cell 22: 918-936
Aoki, K., Yano, Y., Suzuki, A., Kawamura, S., Sakurai, N., Suda, K., Kurabayashi, A., Suzuki, T., Tsugane, T., Watanabe, M., Ooga, K., Torii, M., Narita, T., Shin-i, T., Kohara, Y., Yamamoto, N., Takahashi, H., Watanabe, Y., Egusa, M., Kodama, M., Ichinose, Y., Kikuchi, M., Fukushima, S., Okabe, A., Arie, T., Sato, Y., Yazawa, K., Satoh, S., Omura, T., Ezura, H. and Shibata, D. (2010) Large-scale analysis of full-length cDNAs from the tomato (Solanum lycopersicum) cultivar Micro-Tom, a reference system for the Solanaceae genomics. BMC Genomics 11: 210
Mitsuya, Y., Takahashi, Y., Berberich, T., Miyazaki, A., Matsumura, H., Takahashi, H., Terauchi, R. and Kusano, T. (2009) Spermine signaling play as significant role in the defense response of Arabidopsis thaliana to cucumber mosaic virus. Journal of Plant Physiology 166: 626-643.
Sagor, G.H.M., Cong, R.-Z., Berberich, T., Takahashi, H., Takahashi, Y. and Kusano, T. (2009) Spermine signaling in defense reaction against avirulent viral pathogen in Arabidopsis thaliana. Plant Signaling & Behavior 4: 1-3.
Igarashi, A., Yamagata, K., Sugai, T., Takahashi, Y., Sugawara, E., Tamura, A., Yaegashi, H., Yamagishi, N., Takahashi, T., Isogai, M., Takahashi, H., Yoshikawa,N. (2009) Apple latent spherical virus vectors for reliable and effective virus-induced gene silencing among a broad range of plants including tobacco, tomato, Arabidopsis thaliana, cucurbits, and legumes. Virology 386: 407-416.
Sekine, K-T., Kawakami, S., Kubota, M., Ichinose, Y., Shah, J., Kang, H-G., Klessig,D.F. and Takahashi, H. (2008) High-level expression of a virus resistance gene, RCY1 confers extreme resistance to Cucumber mosaic virus in Arabidopsis thaliana. Molecular Plant-Microbe Interaction 21: 1398-1407.
Ishihara, T., Sekine, K.-T., Hase, S., Kanayama, Y., Seo, S., Ohashi, Y., Kusano, T., Shibata, D., Shah, J. and Takahashi, H. (2008) Overexpression of the Arabidopsis thaliana EDS5 gene enhances resistance to viruses. Plant Biology 10: 451-461.
Kim, B., Masuta, C., Matsuura, H., Takahashi, H. and Inukai, T. (2008) Veinal necrosis induced by Turnip mosaic virus infection in Arabidopsis is a form of defense response accompanying HR-like cell death. Molecular Plant-Microbe Interactions 21: 260-268.
Mitsuya, Y., Takahashi, Y., Uehara, Y., Berberich, T., Miyazaki, A., Takahashi, H. and Kusano, T. (2007) Identification of a novel Cys2/His2-type zinc-finger protein as a component of a spermine-signaling pathway in tobacco. Journal of Plant Physiology 164: 785-793.
Sekine, K.-T., Ishihara, T., Hase, S., Kusano, T., Shah, J. and Takahashi, H. (2006) Single amino acid alterations in Arabidopsis thaliana RCY1 compromise resistance to Cucumber mosaic virus, but differentially suppress hypersensitive response-like cell death. Plant Molecular Biology 62: 669-682.
Takahashi, H., Shimizu, A., Arie, T., Rosmalawati, S., Fukushima, S., Kikuchi, M., Hikichi, Y., Kanda, A., Ohnishi, K., Ichinose, Y., Yasuda, C., Kodama, M., Egusa, M., Masuta, C., Sawada, H., Shibata, D., Hori, K. and Watanabe, Y. (2005) Catalog of Micro-Tom tomato responses to common fungal, bacterial and viral pathogens. Journal of General Plant Pathology 71: 8-22.
Uehara, Y., Takahashi, Y., Berberich, T., Miyazaki, A., Takahashi, H., Matsui, K., Ohme-Takagi, M., Saitoh, H., Terauchi, R. and Kusano, T. (2005) Tobacco ZFT1, a transcriptional repressor with a Cys2/His2 type zinc finger motif that functions in spermine-signaling pathway. Plant Molecular Biology 59: 433-446.
Zheng, M.S., Takahashi, H., Miyazaki, A., Yamaguchi, K. and Kusano, T. (2005) Identification of the cis-acting elements in Arabidopsis thaliana NHL10 promoter responsible for leaf senescence, the hypersensitive response against Cucumber mosaic virus infection, and spermine treatment. Plant Science 168, 415-422.
Takahashi, H., Kanayama, Y., Zheng, M. S., Kusano, T., Hase, S., Ikegami, M. and Shah, S. (2004) Antagonistic interactions between the SA-and JA-signaling pathways in Arabidopsis modulate expression of defense genes and gene-for-gene resistance to Cucumber mosaic virus. Plant Cell Physiology 45: 803-809.
Sekine, K.-T., Nandi, A., Ishihara, T., Hase, S., Ikegami, M., Shah, S. and Takahashi, H. (2004) Enhanced resistance to Cucumber mosaic virus in the Arabidopsis thaliana ssi2 mutant is mediated via an SA-independent mechanism. Molecular Plant-Microbe Interaction 17: 623-632.
Ishihara, T., Sakurai, N., Sekine, K.-T., Hase, S., Ikegami, M., Shibata, D. and Takahashi, H. (2004) Comparative analysis of expressed sequence tags in resistant and susceptible ecotypes of Arabidopsis thaliana infected with Cucumber mosaic virus. Plant Cell Physiology 45: 470-480
Zheng, M.S., Takahashi, H., Miyazaki, A., Hamamoto, H., Shah, J., Yamaguchi, I. and Kusano, T. (2003) Up-regulation of Arabidopsis thaliana NHL10 in the hypersensitive response to Cucumber mosaic virus infection and in senescing leaves is controlled by signaling pathways that differ in salicylate involvement. Planta 218: 740-750.
Honda, A., Takahashi, H., Toguri, T., Ogawa, T., Hase, S., Ikegami, M. and Ehara Y. (2003) Activation of defense-related gene expression and systemic acquired resistance in Cucumber mosaic virus-infected tobacco plants expressing the mammalian 2’5’oligoadenylate system. Archives of Virology 148: 1017-1026.
Takahashi, H., Miller, J., Nozaki, Y., Sukamuto, Takeda, M., Shah, J., Hase, S., Ikegami, M., Ehara, Y. and Dinesh-Kumar, S. P. (2002) RCY1, an Arabidopsis thaliana RPP8/HRT family resistance gene, conferring resistance to cucumber mosaic virus requires salicylic acid, ethylene and a novel signal transduction mechanism. Plant Journal 32: 655-667.
Ishihara, T., Takahashi, H., Hase, S., Sato, T., Ikegami, M. and Ehara, Y. (2002) Ultrastructure of necrotic lesions in Nicotiana glutinosa leaves locally infected with a variant of Cucumber mosaic virus. Journal of Phytopathology 150: 553-556.
Matushita, Y., Yoshioka, K., Shigyo, T., Takahashi, H. and Nyunoya, H. (2002) In vivo phosphorylation of the movement protein of Cucumber mosaic virus in transgenic tobacco plants. Virus Genes 24: 231-234.
Takahashi, H., Suzuki, M., Natsuaki, K., Shigyo, T., Hino, K., Teraoka, T., Hosokawa,D. and Ehara, Y. (2001) Mapping the virus and host genes involved in the resistance response in Cucumber mosaic virus-infected Arabidopsis thaliana. Plant Cell Physiology 42: 340-347.
Takahashi, H., Sugiyama, M., Sukamto, Karasawa, A., Hase, S. and Ehara, Y. (2000) A variant of Cucumber mosaic virus is restricted to local lesions in inoculated tobacco leaves with a hypersensitive response. Journal of General Plant Pathology 66: 335-344.
Sugiyama, M., Sato, H., Karasawa, A., Hase, S., Takahashi, H. and Ehara, Y. (2000) Characterization of symptom determinants in two mutants of cucumber mosaic virus Y strain, causing distinct mild green mosaic symptoms in tobacco. Physiological and Molecular Plant Pathology 56: 85-90.
Sato, H., Hase, S., Sugiyama, M., Karasawa, A., Suzuki, T., Takahashi, H. and Ehara, Y. (2000). A Novel Satellite RNA of Cucumber mosaic virus induces unique line-pattern mosaic symptoms in tobaccos. Journal of Phytopathology 148: 47-51.
Chida, Y., Okazaki, K., Karasawa, A., Akashi, K., Nakazawa-Nasu, Y., Hase, S., Takahashi, H. and Ehara, Y. (2000) Isolation of molecular markers linked to the Cry locus conferring resistance to Cucumber mosaic cucumovirus infection in cowpea. Journal of General Plant Pathology 66: 242-250.
【総説・著書リスト】 (2005 - 2010 年)
Takahashi, H. (2008) Study on interaction between Cucumber mosaic virus and host plants at a molecular level. Journal of General Plant Pathology 74: 454-456.
高橋英樹 (2008)「キュウリモザイクウイルスー宿主植物の相互作用に関する分子生理学的研究」 日本植物病理学会報74: 134-136.
高橋英樹 (2007) 「キュウリモザイクウイルス抵抗性におけるシグナル伝達機構」 微生物の病原性と植物の防御応答(上田一郎編著)pp87-98 北海道大学出版会
増田税・高橋英樹 (2007) 「植物のウイルスに対する防御機構」ウイルス研究の現在と展望」 蛋白質核酸酵素( 野本明男・西山幸廣編集)Vol.52, No.10, pp1221-1226.
Arie, T., Takahashi, H., Kodama, M. and Teraoka, T. (2007) Tomato as a model plant for plant-pathogen interactions. Plant Biotechnology 24: 135-157.
高橋英樹 (2005) 「キュウリモザイクウイルスーシロイヌナズナ系におけるNBS-LRR 遺伝子ファミリーの発現・機能解析」 平成17 年度植物感染生理談話会論文集—植物・病原体相互反応における特異性決定機構— 41: 41-48.
Takahashi, H., Sekine, K.-T., Ishihara, T., Hase, S., Ikegami, M. and Shah, J. (2005) “Signal transduction pathways for the resistance response to Cucumber mosaic virus.” Genomic and Genetic Analysis of Plant Parasitism and Defense. In 9th Japan-USA Scientific Seminar (Eds. S. Tsuyumu, J. Leach, T. Shiraishi and T. Walpert), APS Press, St Paul, Minnesota, USA, pp185-194.
高橋英樹 (2004) 「ウイルス感染に対する宿主応答」新しい作物保護の展開-バイオサイエンスのかけはし-(羽柴輝良監修)pp274-284 ソフトサイエンス社
高橋英樹 (2004) 「ウイルスに対する宿主抵抗性」新版分子レベルからみた植物の耐病性( 島本功・渡辺雄一郎・柘植尚志 監修)植物細胞工学シリーズ19 pp182-188 秀潤社
高橋英樹 (2004) 「ウイルス感染に対する宿主応答」 平成16 年度植物感染生理談話会論文集—自他識別と応答のバイオフロンティア— 40: 127-139.
高橋英樹・野崎雪音・スカムト・武田愛・長谷修・江原淑夫 (2002) 「キュウリモザイクウイルスーシロイヌナズナ系におけるウイルス抵抗性反応」 植物ウイルス病研究会レポート8: 69-77.
高橋英樹・江原淑夫 (2000) 「キュウリモザイクウイルスに対する宿主応答とシグナル伝達」 平成12 年度植物感染生理談話会論文集—植物と微生物相互作用の夜明け— 36: 103-120.
ー 研究の詳細 ー
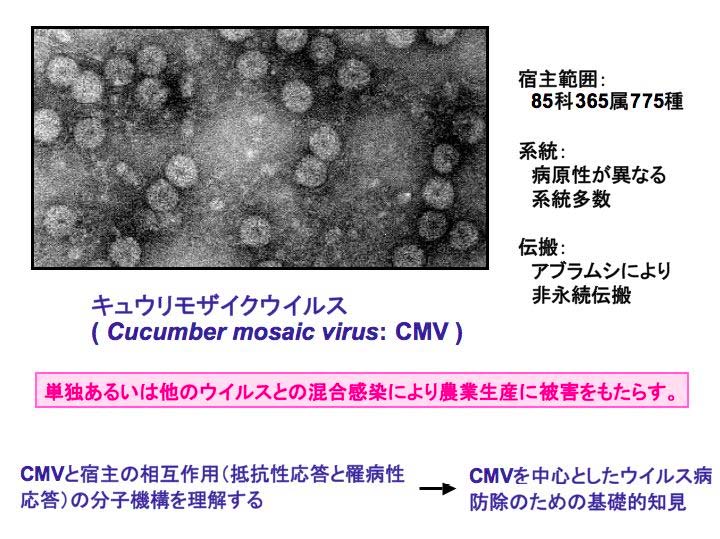
【研究の背景】 キュウリモザイクウイルス(CMV)は85科365属775種の植物を宿主とし、病原性の異なる多くの系統が存在することから、農業生産に大きな被害を与えている。宿主植物におけるCMV 抵抗性のしくみを理解することはウイルス病防除において非常に重要であるが、その分子機構についてはほとんど明らかになっていない。
【研究の目的】
シロイヌナズナ(Arabidopsis thaliana)はCMV の宿主であるが、シロイヌナズナのエコタイプC24 はCMV 黄斑系統[CMV(Y)] に対して過敏感反応(HR)による抵抗性を示し、CMV インドネシア系統[CMV(B2)] には全身感染して罹病性を示す。一方、エコタイプCol は両CMV 系統に罹病性である。過去約10年間の研究では、このCMV(Y)感染C24 における抵抗性の分子機構を解明するため、〈1〉CMV(Y) とCMV(B2) のあいだでウイルスゲノムRNA を組み換えることによって作成されたpseudorecombinant ウイルスによる非病原性遺伝子の解析、(2)エコタイプC24 とCol の交配後代を用いた遺伝分析による抵抗性遺伝子(RCY1)のマッピングとポジショナルクローニング法による抵抗性遺伝子の単離、(3)シロイヌナズナ変異体を用いた抵抗性シグナル伝達系の解析、(4)CMV 感染に伴い発現が変動する宿主遺伝子の網羅的解析、(5) yeast two-hybrid 法による非病原性遺伝子産物と結合する宿主タンパク質の単離と機能解析を行った。さらに現在、(6)RCY1 タンパク質の機能解析を進めている。
【研究成果】
1.CMV における非病原性遺伝子の解析
CMV は3分節ゲノムRNA を有することから、CMV(Y)抵抗性に関わるウイルス因子を明らかにするため、CMV(Y)とCMV(B2) の間でpseudorecombinant ウイルスを作成し、C24 における抵抗性誘導を調べたところ、RNA3 が抵抗性発現に関与していることが明らかになった。RNA3 には細胞間移行タンパク質(3a)と外被タンパク質(CP)がコードされていることから、CMV(Y)とCMV(B2) 間でキメラRNA3 を作成し、CMV(Y)RNA1, RNA2 とともにC24 に接種を行った。その結果、CMV 外被タンパク質遺伝子が非病原性遺伝子として機能していることが明らかになった。
2. CMV(Y) 抵抗性遺伝子の解析
C24 とCol の交配後代(F2) を用いてCMV(Y)抵抗性について遺伝分析を行ったところ、抵抗性は単一優性遺伝子により支配されていることが明らかになった。そのCMV
抵抗性遺伝子[RCY1; Resistance to CMV(Y)]を単離するため、約980個体のF2を用いて高密度マッピングを行ったところ、RCY1 は第5染色体の長腕上の約150kbの領域にマップされた。この領域はMRC-Jと呼ばれ、糸状菌や細菌などの病原体に対する抵抗性遺伝子が多数存在する領域のひとつである。全ゲノム塩基配列が決定されているCol のこの領域の塩基配列にもとづき抵抗性遺伝子様のタンパク質をコードしている遺伝子(R1)を見出した。CMV(Y)感受性C24 変異体ではこの遺伝子内に塩基の欠失が認められ、この遺伝子を感受性エコタイプWSに形質転換したところウイルス抵抗性が高まったことから、R1はRCY1 であると結論した。RCY1 がコードするRCY1 タンパク質は、分子量104kDa でCoiled coil(CC) -Nucleotide binding (NB)
- Leucine-rich repeats (LRR) 構造を含んでいることから、既報の病害抵抗性遺伝子のNB-LRR ファミリーの中の、CC-NB-LRR
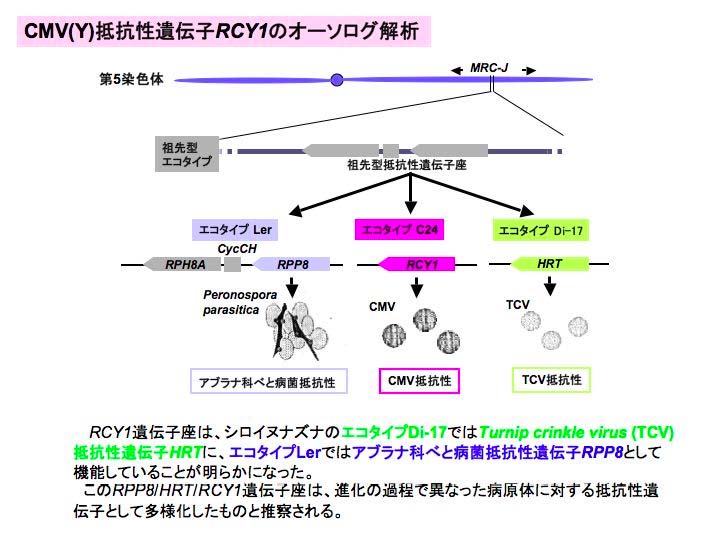
グループに属するものと考えられた。また、C24 のRCY1 遺伝子座について他のエコタイプとの比較解析を行ったところ、RCY1 は、エコタイプLer のPeronospora 抵抗性遺伝子RPP8 やエコタイプDi-17のTurnip crinkle virus (TCV)抵抗性遺伝子HRT の対立遺伝子であることが明らかになった。したがって、RCY1 、RPP8 、HRT は、共通の祖先抵抗性遺伝子に由来するものと考えられた(図3)。
3.CMV(Y) 抵抗性に関わるシグナル伝達系の解析
(1) CMV(Y)抵抗性におけるサリチル酸、ジャスモン酸、エチレンを介したシグナル伝達系の役割
シロイヌナズナでは、シグナル伝達系に異常をきたした様々な変異体が単離されている。病害抵抗性への関与が報告されているサリチル酸(SA)、ジャスモン酸(JA)、エチレン(ethylene)を介したシグナル伝達系に異常をきたしている変異体(nahG, eds5-1, npr1-5, coi1, jar1, etr1-3, ein2-1)をC24 と交配し、F2集団より各変異遺伝子とRCY1 をいずれもホモに持つ個体を選抜した。得られた変異体にCMV(Y)を接種し、接種葉における局部壊死病斑の出現とウイルスの接種葉への局在化について解析した。その結果、coi1 RCY1 変異体とjar1 RCY1 変異体ではC24 と同様に抵抗性が誘導されたのに対して、nahG RCY1 変異体とeds5-1 RCY1 変異体では約15%の個体でウイルスの全身移行が認められた。しかし、SAの下流に位置するNPR1 の変異体(npr1-5 RCY1)ではすべて抵抗性を示したことから、NPR1-independent でSAを介したシグナル伝達系が抵抗性に関わっていることが明らかになった。また、etr1-3 RCY1 変異体とein2-1 RCY1 変異体では、約8%の個体でウイルスの全身移行が認められたことから、エチレンを介したシグナル伝達系の関与も明らかになった。さらに、2重変異体nahG etr1-3 RCY1 変異体にCMV(Y)を接種したところ、約57%の個体でウイルスの全身移行が認められたが、すべての個体が罹病性を示すことはなかった。したがって、RCY1 によるCMV(Y) 抵抗性の発現には、SAとエチレンを介したシグナル伝達系が関与しているが、それら以外に抵抗性発現を調節している新規のシグナル伝達系が存在するものと推察した。�
(2) CMV(Y)抵抗性におけるサリチル酸シグナル伝達系とジャスモン酸シグナル伝達のクロストーク
SAとJAを介したシグナル伝達系にそれぞれ異常をきたした変異体eds5 とcoi1 を交配することによって得られた2重変異体(eds5 coi1 RCY1)を用いて、CMV(Y) 抵抗性と防御関連遺伝子(PR-1, PR-5, PDF1.2, HEL)の発現を調べた。その結果、CMV(Y)接種葉におけるSAシグナル伝達系を介した抵抗性誘導とPR-1とPR-5の発現は、eds5 変異によって阻害され、coi1 変異によって回復した。また、JAシグナル伝達系を介したPDF1.2 とHEL 遺伝子の発現は、CMV(Y)を接種した野生型ではわずかに誘導されるのみであるが、eds5 変異によって強く誘導された。したがって、CMV(Y)感染C24 では、SAシグナル伝達系とJAシグナル伝達系が拮抗的にクロストークしているものと考えられた。
(3) CMV(Y)抵抗性におけるEDS1、NDR1非依存性シグナル伝達系の存在
TIR-NB-LRR クラスの抵抗性遺伝子に支配されている抵抗性シグナル伝達系の下流では、リパーゼ様タンパク質をコードするEDS1 が機能しているのに対して、CC-NB-LRR クラスに属する抵抗性遺伝子の多くは、そのシグナル伝達系の下流にmembrane-associated protein をコードするNDR1 が存在することが知られている。RCY1 によるCMV(Y)抵抗性にはいずれの遺伝子が関与しているかについて、ndr1 とeds1 変異体をそれぞれ交配した後代を用いて調べたところ、いずれもCMV(Y)抵抗性を示した。したがって、RCY1 によるCMV(Y)抵抗性には、NDR1 、EDS1 非依存シグナル伝達系が関与しているものと考えられた。NDR1 、EDS1 非依存シグナル伝達系の存在については、これまでにべと病菌抵抗性遺伝子(RPP7, RPP8, RPP13)で報告されているのみである。
(4) 脂質を介したシグナル伝達系とCMV 抵抗性
RCY1 によるCMV(Y)抵抗性発現には、SA シグナル伝達系が重要な役割を果たしていることから、SA シグナル伝達系が恒常的に活性化されているシロイヌナズナ変異体(cpr5, acd1, acd2, ssi1, ssi2)のCMV(Y)抵抗性について検討した。その結果、接種葉におけるウイルス増殖、上位葉へのウイルス移行とも野生型と変異体(cpr5, acd1, acd2, ssi1)の間に明瞭な差は認められなかった。しかし、興味深いことにssi2 変異体のみで、CMV(Y)の増殖と全身移行の顕著な抑制が認められた。一方、SA シグナル伝達系の恒常的活性化が抑制されている2重変異体であるssi2 sfd1 変異体とssi2 sfd4 変異体にCMV(Y)を接種したところ、抵抗性がなくなっていた。SSI2 はstearyl-ACP desaturase を、SFD1 とSFD4 はそれぞれglycerol phosphate dehydrogenase とplastidic ω6-desaturase をコードしていることから、脂質を介したシグナルがCMV(Y)の増殖移行を負に制御している可能性が考えられた。しかし、この脂質が関与するシグナル伝達系が、RCY1 によって支配されているCMV(Y)抵抗性に直接関与しているかどうかについてはさらに検討が必要である。
4. CMV 感染における宿主遺伝子発現変動の網羅的解析
CMV(Y)に抵抗性のエコタイプであるC24 と罹病性であるCol について、約13,000 のcDNA をスポットしたマクロアレイを用いて宿主遺伝子の発現を網羅的に解析した。CMV(Y)接種後0、6、12、24 時間(局部壊死病斑は接種後24-28 時間後に出現)について遺伝子発現の変動を調べたところ、接種後48 時間では、抵抗性と罹病性を合わせて788 遺伝子の発現が誘導され、150 遺伝子の発現が抑制されていた。またこれらの中で、誘導された29 遺伝子と抑制された26 遺伝子は、抵抗性と罹病性で共通していた。一方、接種後6 時間では、抵抗性でわずか6 遺伝子、罹病性で20 遺伝子の発現が変化したが、抵抗性と罹病性に共通して変動する遺伝子はまったく存在しなかった。したがって、感染初期(6 時間)において、抵抗性と罹病性で異なった宿主応答が誘導されていることが、遺伝子発現変動のレベルで明らかになった。
5. CMV 外被タンパク質と結合する宿主タンパク質の単離と機能解析
CMV(Y)の非病原性遺伝子産物である外被タンパク質が、抵抗性発現において具体的にどのような機構で抵抗性シグナル伝達系を活性化させているのか興味がもたれる。そこで、タバコを用いてyeast two-hybrid 法により外被タンパク質と結合する宿主タンパク質のスクリーニングを行った。その結果、SNF1 protein kinase homolog が単離された。次に、CMV と宿主の相互作用において、CP とSNF1 protein kinase homolog の結合がどのような役割を果たしているのか解析するため、35S promoter 制御下でSNF1 protein kinase homolog を過剰発現させた形質転換タバコ(Xanthi nc)を作成した。CMV(Y)はタバコ(Xanthi nc)の接種葉に非常に弱い黄色病斑を生じるが、SNF1 protein kinase homolog 過剰発現形質転換体の中にはCMV(Y)接種葉に激しい黄色病斑を生じる個体も認められた。また、形質転換体3 ラインについて、葉の老化に伴い発現することが知られているSEN1 遺伝子の発現を調べたところ、すべてのラインでコントロールと比較して急速にSEN1 遺伝子が発現することが明らかになった。一方、CMV(Y)の外被タンパク質の36 番アミノ酸をセリンからプロリン、111 番アミノ酸をバリンからイソロイシンに変異させたCMV 変異体[CMV(Y/GM2tr)] は、タバコ(Xanthi nc)に過敏感反応を誘導する。過剰発現タバコにCMV(Y/GM2tr)を接種したところ、コントロールと比較して局部壊死病斑のサイズが拡大し、ウイルスの局在化も弱められていた。また、過敏感反応に伴い発現することが知られているHIN1 遺伝子とHSR203J 遺伝子の発現を調べたところ、コントロールと比較して発現量の上昇が認められた。CMV(Y)のCP は、タバコ接種葉における黄色病斑形成(全身感染) と局部壊死病斑形成(局部感染)のいずれにも関与することがすでに明らかになっているが、CP が結合するSNF1 protein kinase homolog を過剰発現させた形質転換タバコでは、コントロールと比較し、CMV(Y)とCMV(Y/GM2tr) に対する宿主応答やSEN1 、HIN1 、HSR203J 遺伝子の発現パターンに変化が認められたことから、CP とSNF1 protein kinase homolog の結合は、全身感染における宿主応答(すなわちVirulence function) と局部感染における宿主応答(すなわちAvirulence function) の両方に関与している可能性が考えられた。SNF1 protein kinase homolog がGuarding hypothesis におけるThird component として機能しているのかどうかは、さらに解析が必要であろう。�
6. RCY1 タンパク質の機能解析
突然変異源であるEMS の処理によるRCY1遺伝子へ変異導入と選抜の結果、RCY1 タンパク質の機能喪失に関わるアミノ酸を8 カ所同定している(図4)。図4 の上図は、1 アミノ酸置換部位(青線)を示した模式図である。図4の下図は、これら8 種類の変異体にウイルスを接種し、病徴発現とウイルスの検出を示している。ウイルス接種葉では、野生型のような細胞死を伴う過敏感反応は認められず、ウイルスは接種葉全体に増殖・移行した。この結果は、さらに他のアミノ酸を置換することにより、抵抗性を増強させたり、他の非生物ストレス耐性の誘導するように、RCY1 タンパク質を改変できる可能性を秘めている。
さらにキュウリモザイクウイルス抵抗性遺伝子RCY1の産物であるRCY1 タンパク質を過剰に蓄積する形質転換体を作出したところ、CMV(Y)に対して高度抵抗性を示した(図5)。図5 の上図はHA タグ付加RCY1 タンパク質の検出データで、ライン#4 では同タンパク質が過剰に蓄積していることが確認できる。図5 の下図は、ウイルス接種による病徴とウイルスの分布(免疫学的手法により紫色のシグナルとして検出)を示している。ライン#4 では、ウイルスによる病徴が現れず、ウイルス増殖も検出できないことから、RCY1 タンパク質の過剰蓄積により、ウイルスに対する高度抵抗性が誘導されていると解釈できる。この結果は、RCY1 タンパク質の発現量をコントロールすることにより、病原体感染に対する耐性( 生物ストレス耐性)を植物に付与できる可能性を示している。

図4 1アミノ酸置換によるRCY1 タンパク質の機能の喪失例
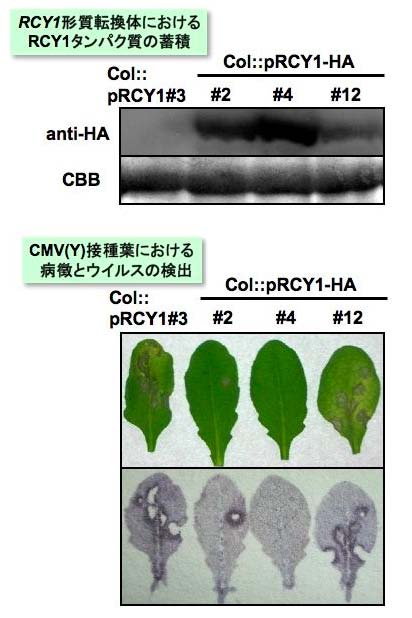
図5 RCY1形質転換体におけるRCY1 タンパク質の蓄積とCMV(Y)対する応答。ライン#4 では、RCY1 タンパク質が過剰蓄積し、ウイルスに対して高度抵抗性を示している。