東北大学 大学院農学研究科

アルツハイマー病:アミロイド生成機構の解明と治療薬
家族性アルツハイマー病(FAD)の原因遺伝子には、2種類の膜タンパク質、アミロイド前駆体(APP)とプレセニリンが見つかっています。このうち、APPは、2種類のプロテアーゼ(タンパク分解酵素;βセクレターゼとγセクレターゼ(右図))で分解されて、アミロイドβペプチド(Aβ)になります。原因遺伝子のプレセニリンは、このγセクレターゼの構成因子です。アルツハイマー病では、Aβが脳内に蓄積して、神経細胞死を引き起こします。Aβは、小胞輸送経路で生成されるため、小胞輸送の異常はアルツハイマー病の発症に直接的に影響すると考えられます。
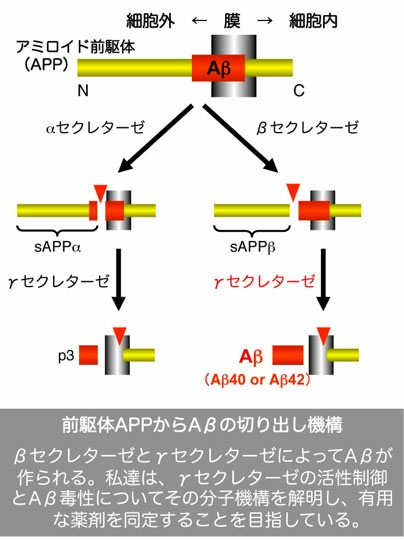
γセクレターゼは、疎水環境である膜内でタンパク分解する不思議な酵素です。色々な長さのアミロイド(Aβ)を生成し、病気の脳内では、毒性の高い”長い”アミロイド(Aβ42など。数字はアミノ酸残基数)が蓄積する事が知られています。
私達は、酵母にヒトγセクレターゼとアミロイド前駆体を導入して、アルツハイマー病患者脳内でのアミロイド生成を再現することに成功しました。生成したアミロイドは生化学的に直接検出することができるほか、レポーター遺伝子を使ってアミロイド生成を検知する(つまり、酵母が生きるか死ぬかでアミロイドができたかが分かる!)こともでき、アミロイド生成機構を解析する実験に用いています(下図)。
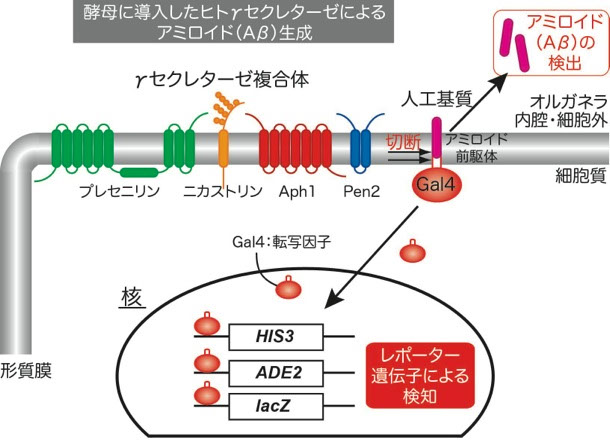
酵母のアミロイド生成系を使って、これまでに、γセクレターゼのアイソフォーム間の活性と特異性の違いを明らかにし、活性が変化する変異体を数多く取得しています。また、創薬への展開を考え、医薬品のシード化合物の取得をめざしたスクリーニング試験を行っています。
【参考文献】
Eugene Futai, Yeast Systems Biology. In Methods in Molecular Biology, 2049, pp 403-417 (2019).
Ohizumi et al., J.Agric.Food Chem., 57, 2896-2902 (2009).
Gaidamashvili et al., J. Biol. Chem.,279 (25), 26028-26035 (2004).
研究内容のトップに戻る
東北大学大学院農学研究科農芸化学専攻
生物化学講座 酵素化学分野
〒980-8572 仙台市青葉区荒巻字青葉 468-1