真核微生物を用いた異種タンパク質の分泌生産

麹菌は安全性が高く, 1リットル当たり数グラムにも達するタンパク質分泌能力を有していることから, 異種タンパク質生産の宿主としての利用が期待されています。しかし, 高等生物を始めとする異種生物由来のタンパク質の分泌生産量は, 必ずしも期待ほど高くないという問題点を抱えています。私たちは麹菌による異種タンパク質の分泌生産において, 宿主細胞のポテンシャルを最大限に引き出すために, mRNA 品質管理機構や小胞体におけるタンパク質品質管理機構の解明に取り組んでいます。
1. 異種遺伝由来 mRNA 分解機構の解明
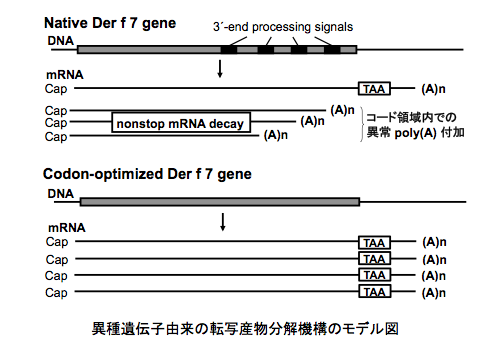
麹菌において遺伝子を高発現させるため、様々な高発現用プロモーターがこれまでに開発されています。しかし, これらの高発現用プロモーターを用いて異種遺伝子を発現させても, 期待したほどの転写産物量が得られないことが報告されています。私たちは, 異種遺伝子のコドンを麹菌のコドンに最適化して発現させることで, 異種遺伝子の転写産物量が数倍に増加することを見いだしました(1)。異種遺伝子転写産物の解析を行った結果, poly(A) 鎖が遺伝子コード領域内に付加した(= 転写が遺伝子コード領域内で終結した)異常な転写産物が生じていることが明らかとなり, コドン最適化によってこの異常な poly(A) 付加が回避されることが明らかとなりました(1)。また, 麹菌において mRNA 安定性を調べる手法を確立し, コドン最適化することで異種遺伝子 mRNA が著しく安定化することを明らかとしました(2)。以上の結果から, 異常 poly(A) 付加により生じた異種遺伝子由来の転写産物が, 終止コドンを持たない異常 mRNA 分解機構 (nonstop mRNA decay) によって急速に分解されることが示唆されました。さらに、網羅的な配列解析を行うことで, poly(A) 鎖が付加する位置を決定する配列要素群(3´-end processing signals) を糸状菌で初めて示しました(3)。現在は異種遺伝子由来 mRNA の分解機構を明らかとすることを目的に研究を行っています。
(1) Tokuoka et al., Appl. Environ. Microbiol., 2008
(2) Tanaka et al., Appl. Microbiol. Biotechnol., 2012
(3) Tanaka and Sakai et al., DNA Res., 2011
2. タンパク質分泌経路における翻訳産物の安定化
合成後の分泌タンパク質ポリペプチドは, まず小胞体で分子シャペロンなどの助けにより折り畳まれ, 正しい立体構造を持つもののみがゴルジ装置以降の分泌経路へと輸送されます。この折りたたみに失敗したタンパク質は小胞体関連分解 (Endoplasmic reticulum-associated degradation; ERAD) と呼ばれる機構で分解されます。また, ERADの網を通り抜けた異常タンパク質は液胞 (動物細胞のリソソームに相当) と呼ばれる加水分解酵素群を含むオルガネラに輸送され分解されます。異種タンパク質は分泌過程において異物と見なされ, これらのタンパク質分解機構により分解される可能性があります。
私たちは, 分解基質のERADおよび液胞へのターゲティング機構を解析し, 組換えタンパク質の分解部位へのターゲティングを回避させ, 効率よく分泌させるシステムの構築を目指しています。
3. 可溶性分泌タンパク質の細胞壁への結合機構の解明
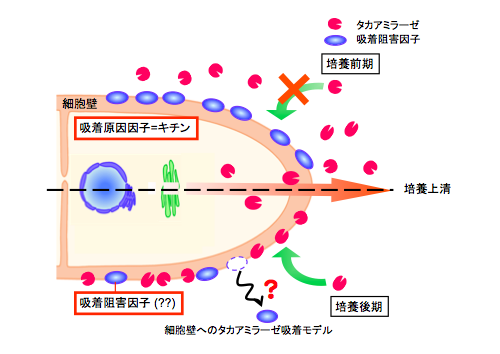
麹菌は菌体外に多量の α-アミラーゼを分泌するものの, 培養中期以降その生産量が著しく低下する現象が認められました。私たちはその原因が転写・翻訳の抑制、翻訳後の分解によるものではなく, 一度分泌されたアミラーゼタンパク質の細胞壁への吸着であることを明らかにしました(1)。さらに, α-アミラーゼの吸着は細胞壁構成成分の一つであるキチンへの結合によって起こることを明らかとしました(1)。また, 培養初期においては, 細胞壁構成成分によってキチンへのタンパク質吸着が阻害されていることが示唆されたことから, 現在はこの吸着阻害成分の同定を目的に研究を行っています。
-
(1)Sato et al., Appl Microbiol. Biotechnol., 2011
2013年10月23日水曜日