| 氏名 | 米山 裕 |
|---|---|
| 職位 | 教授 |
| TEL | 022-757-4364 |
| FAX | 022-757-4365 |
| hiroshi.yoneyama.a4*tohoku.ac.jp (*を@に換えてください) | |
| 専門分野 | 応用微生物学、動物微生物学 |
| 経歴 | 東北大学大学院農学研究科博士前期課程修了後、協和発酵工業株式会社入社、医薬研究所にて抗生物質の開発研究に携わる。その後、東海大学医学部細胞情報科学教室に着任し、緑膿菌の外膜透過性・薬剤耐性に関する研究を行い、2000年東北大学大学院農学研究科に着任、現在に至る。 |
| Research map | https://researchmap.jp/?lang=ja |
| 研究内容 | |
|
1.細菌の環境ストレス(栄養飢餓ストレス)に対する生存戦略に関する研究 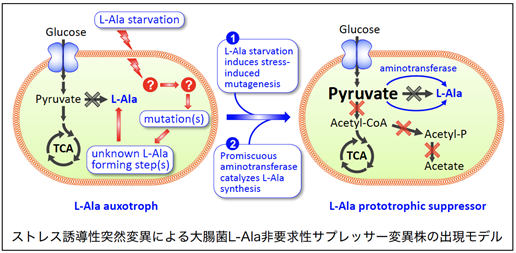 | |
|
2.病原因子を標的とした新規抗生物質アジュバントの探索 | |
|
3.抗菌ペプチドを利用した細菌感染症に対する新規防除法の開発に関する研究 | |
|
4.ウシ乳房炎の新規治療戦略構築に向けた黄色ブドウ球菌特異的ペプチドの取得とその性状評価 | |
| シーズ | |
|
ペニシリンの発見以来、各種抗菌剤が発見され重篤な細菌感染症は制御しうる病となりました。しかし近年、多剤耐性能を有する病原細菌が出現し公衆衛生上の社会問題となっています。これら細菌感染症の脅威に対抗するためには、新規抗菌剤の継続的な研究開発が必須であり社会的にも強く求められています。既存の抗菌剤の多くは細菌の生存に必須の代謝過程をターゲットとしているため、同様の戦略で新規抗菌剤が開発されても耐性菌の出現を回避することはできません。一方、病原細菌が宿主に感染する際に必要な病原因子は細菌の生存に必ずしも必要ではないため、その阻害剤に対する耐性菌の出現頻度は低いと考えられ新規抗菌剤のターゲットとして関心が集まっています。我々はこのような病原因子のなかで新規なタンパク質分泌系であるTat(Twin-arginine translocation)系と鉄代謝系に注目し、それらを標的とする新しいスクリーニング系を開発することに成功しました(参考文献1〜3)。
(1) Tat Pathway-Mediated Translocation of the Sec Pathway Substrate Protein MexA, an Inner Membrane Component of the MexAB-OprM Xenobiotic Extrusion Pump in Pseudomonas aeruginosa. Antimicrob. Agents Chemother. 54, 2010, 1492-1497. (2) Tat Pathway-Mediated Translocation of the Sec-pathway Substrate , OprM, an Outer Membrane Subunit of the Resistance-Nodulation-Division Xenobiotic Extrusion Pumps, in Pseudomonas aeruginosa. Chemotherapy, 59, 2013, 129-137. (3) Development of a Novel Antimicrobial Screening System Targeting the Pyoverdine-Mediated Iron Acquisition System and Xenobiotic Efflux Pumps. Molecules 20, 2015, 7790-7806. 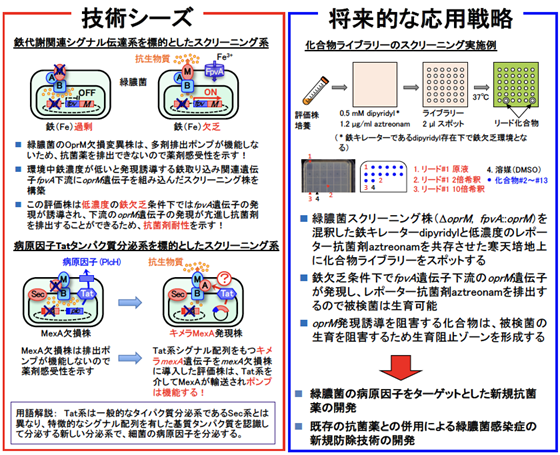 |
|




