創薬化学
創薬化学とは、医薬を創製するための有機化学です。医薬の種(化合物)を化学合成するだけでなく、標的分子と化合物の相互作用の理解、その相互作用を強くする分子設計、設計した化類縁体の化学合成、分子設計の妥当性を解析する構造活性相関、薬らしい振る舞いを付与する化学構造のチューニングなども創薬化学に含まれます。このことから創薬化学は、有機化学に加えて、生物学、物理化学、薬物動態学、計算化学などの理解も必要な学際研究と言えます。
近年、低分子創薬に加えて様々な手法(モダリティ)が注目を浴びています。有機化学を基盤としながらも、タンパク質修飾や中分子など創薬の学際性は広がっています。このようななか、広い視野が益々重要になっていると思われます。
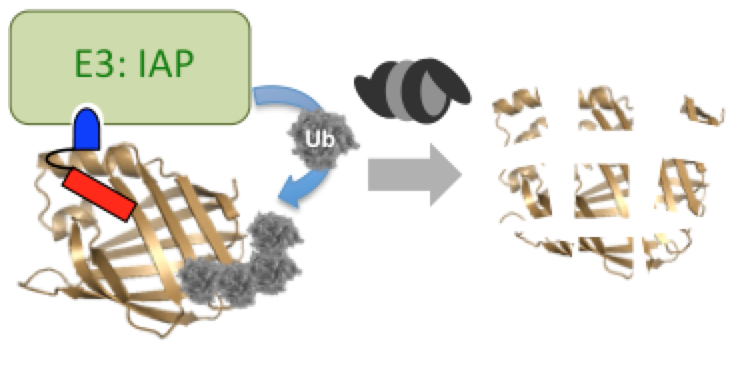
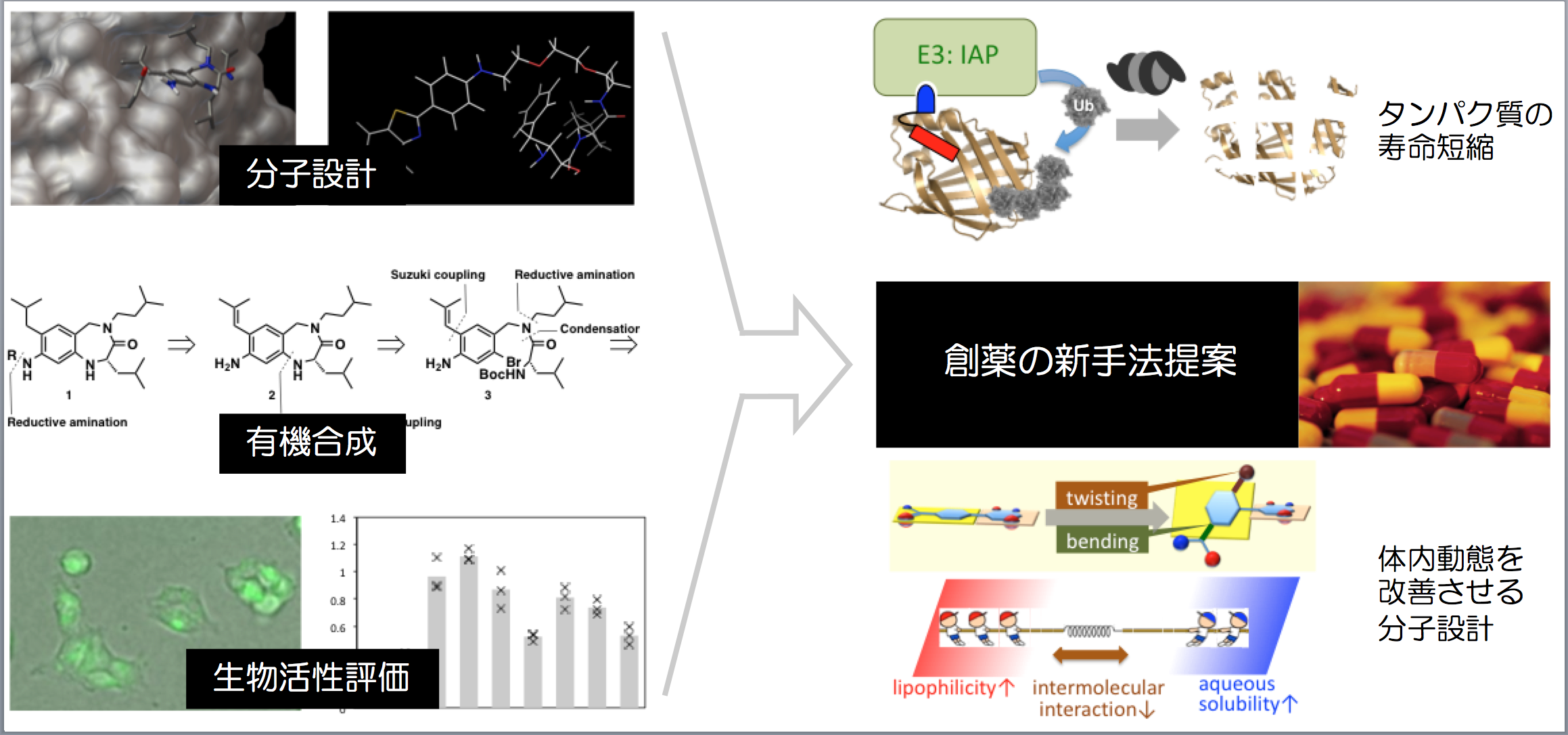
細胞内の標的タンパク質を分解誘導する低分子
これまでの低分子創薬の主流は、疾患に関連するタンパク質の機能を制御する化合物の探索でしたが、この方法では対応できない疾患が多く存在します。この課題に対して、細胞内の標的タンパク質を分解誘導する低分子PROTAC(proteolysis targeting chimera)が、新しい創薬手法として注目されています。PROTACは、酵素ユビキチンリガーゼのリガンドと標的タンパク質のリガンドを連結した分子で、標的タンパク質をユビキチンリガーゼに人工的に近接させることによって、ユビキチン・プロテアソーム系を介して標的タンパク質を分解します。
私達(旧所属:東京大学分子細胞生物学研究所生体有機化学研究分野)は、PROTAC創世記から研究を開始し、低分子PROTACをいち早く創製しました。即ち、阻害剤が知られていないレチノイン酸結合タンパク質(CRABP)とユビキチンリガーゼの一種IAPの両方に結合する低分子PROTACを合成し、このPROTACがCRABPの分解誘導作用と、それによる抗がん作用(細胞増殖抑制作用や遊走阻害作用)を示すことを明らかにしました。
神経変性疾患は、疾患原因タンパク質の異常凝集により発症し、根治療法が存在しない難病です。私達は、凝集タンパク質に特異的に結合する神経変性疾患診断薬とIAPリガンドを連結した低分子PROTACを設計・合成しました。その結果、凝集性タンパク質を減少させる低分子PROTACを世界に先駆けて報告し、神経変性疾患に対する創薬手法を提案しました。
J. Am. Chem Soc. 2010, 132, 5820.
Angew. Chem. Int. Ed. 2017, 56, 11530.
Angew. Chem. Int. Ed. 2021, 60, 3346.
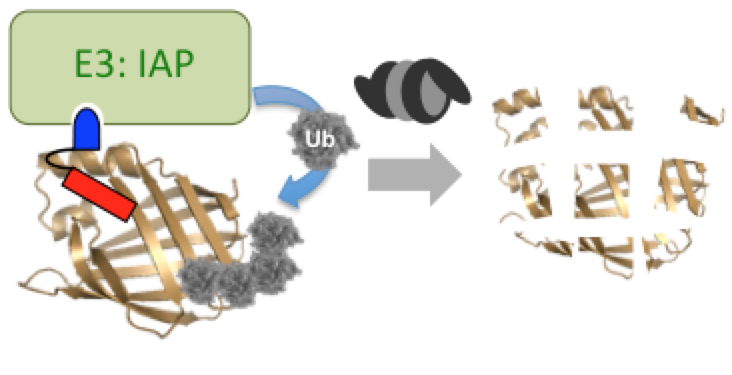
標的タンパク質の寿命を短縮する低分子
酵素ユビキチンリガーゼは、不要になった基質タンパク質と結合してユビキチンを付加することにより、そのタンパク質を分解へ導きます。この生体内のタンパク質分解経路であるユビキチン・プロテアソーム系を活用して標的タンパク質を分解誘導する低分子を、私達(旧所属:東京大学定量生命科学研究所生体有機化学研究分野)は創製しました。即ち、阻害剤が知られていない結合タンパク質であるレチノイン酸結合タンパク質(CRABP)とユビキチンリガーゼの1種IAPの両方に結合する合成低分子が、CRABPの分解誘導作用と、それによる抗がん作用(細胞増殖抑制作用や遊走阻害作用)を示すことを明らかにしました。ところで神経変性疾患は、疾患原因タンパク質の異常凝集により発症し、根治療法が存在しない難病です。私達は、凝集タンパク質に特異的に結合する神経変性疾患診断薬とIAPリガンドの連結低分子を設計・合成しました。その結果、凝集性タンパク質を減少させる低分子を報告し、神経変性疾患に対する創薬手法を提案しました。標的タンパク質の存在量を低分子で減少させる本手法は、タンパク質の機能を制御する従来の創薬手法とは全く異なり、新しい創薬モダリティとして期待されています。
J. Am. Chem Soc. 2010, 132, 5820.
Angew. Chem. Int. Ed. 2017, 56, 11530.
Angew. Chem. Int. Ed. 2021, 60, 3346.

ミトコンドリアのタンパク質を分解する低分子
がんや神経変性疾患などの疾患とミトコンドリアとの関わりが明らかになり、ミトコンドリアを標的とする創薬手法の開発に関心が寄せられています。一方、生体内のタンパク質分解機構を利用して、任意のタンパク質を選択的に分解誘導する標的タンパク質分解(targeted protein degradation, TPD)が、新しい創薬手法として注目されています。このTPDによって、細胞質・核・細胞膜・細胞外などに存在する標的タンパク質を分解することが可能になりました。しかし、ミトコンドリアに存在するタンパク質は、独自のタンパク質分解機構を介して分解されているため、従来のTPDでは分解できませんでした。
私達は、ミトコンドリアで機能するTPD技術「mitoTPD」を開発しました。すなわち、ミトコンドリアのプロテアーゼClpPを活性化する低分子と、タグタンパク質に対する低分子リガンドを連結した低分子分解薬が、ミトコンドリアに発現するタグタンパク質をプロテアーゼClpPに人工的に近接させ、分解へ導くことを、私達は示しました。本分解薬は、タグを融合した任意のミトコンドリアタンパク質を理論上分解できることから、ミトコンドリアタンパク質の機能解明ツールとして応用が期待されます。加えて、タグタンパク質リガンドの代わりにミトコンドリアタンパク質リガンドを連結した低分子分解薬は、任意のミトコンドリアタンパク質を理論上分解できるため、医薬応用も期待されます。
Chem. Sci. 2024, 15, 14625
生命科学研究科プレスリリース
東北大学プレスリリース
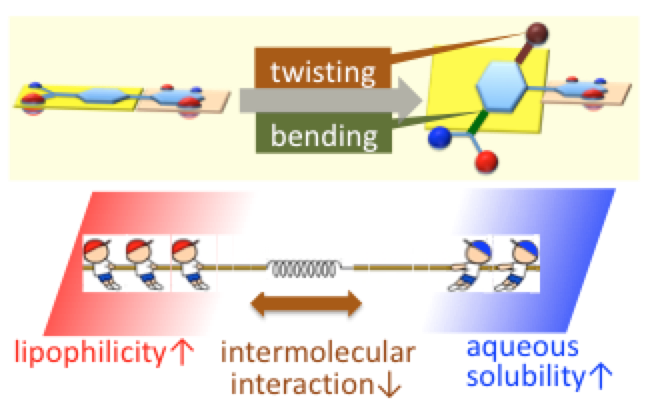
体内で薬らしく振る舞う分子の設計法(医薬リード化合物の体内動態改善法)
医薬品のリード化合物のスクリーニング・類縁体合成において、検討数より質(薬らしい構造・物性)の重要性が提唱されています。なかでも化合物の水溶性は、薬効や経口吸収性などに大きな影響を与えることから、薬らしさの重要な指標です。水溶性も含めた薬らしい物性を獲得するために、創薬の現場では試行錯誤しながらリード化合物の構造を変換していると言えるのではないでしょうか。私達は、分子間相互作用を減弱するべく、ビアリール基オルト位への置換基導入(非平面化)、もしくは分子構造の屈曲化などへ構造変換したリード化合物の類縁体は、リード化合物と比較して水溶性が向上する一般則を見出しました。重要な発見として、構造変換により化合物の脂溶性が増加した例においても、本手法により一般性良く水溶性を向上できました。即ち、一般的には分子のLogPが低い程水溶性が高いことが知られていましたが、本研究によりこの常識を覆したと言えます。医薬の経口吸収性には高い脂溶性と高い水溶性の相反する性質が同時に求められるため、LogPを低下させる既存の水溶性向上策では解決できない場面が多いのに対し、本手法はこの矛盾を解決し得ます。
J. Med. Chem. 2011, 54, 1539
The Practice of Medicinal Chemistry (Forth Edition) p747-765, Academic Press(分担執筆)
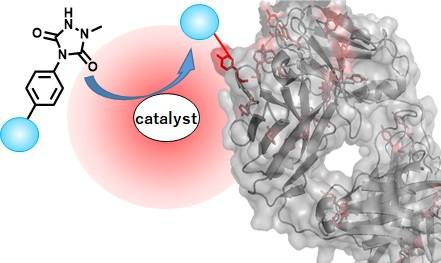
ラジカル反応によるチロシン残基の化学修飾
タンパク質と低分子化合物の間に共有結合を形成させる技術(ケミカルラベリング)は、近年盛んに研究されている抗体薬物複合体などのバイオ医薬分野の創薬科学や、タンパク質を基盤としたバイオマテリアル創出に必要不可欠な技術です。タンパク質ケミカルラベリングを達成するには、水中、中性付近pH、37℃以下の温度で、迅速に、特定のタンパク質構造と共有結合を形成する反応を開発する必要があります。即ち、通常の有機化学反応開発とは異なるアプローチ・着眼点からの研究が求められます。我々はこれまで特異的な修飾が困難であったタンパク質構造中のチロシン残基をラベル化することに挑戦してきました。高反応性化学種を活用したチロシン残基の特異的かつ効率的な機能化手法、ラジカル反応の局所性を利用したタンパク質の部位特異的機能化法、生物活性物質の標的タンパク質同定法の開発を行っています。
Angew. Chem. Int. Ed. 2013, 52, 8681
Bioconjugate Chem. 2015, 26, 250
ACS Chem. Biol. 2015, 10, 2633
Chem. Commun. 2017, 53, 4838
Chem. Commun. 2018, 54, 5871
Chem. Commun. 2019, 55, 13275
Bioconjate Chem. 2020, accepted
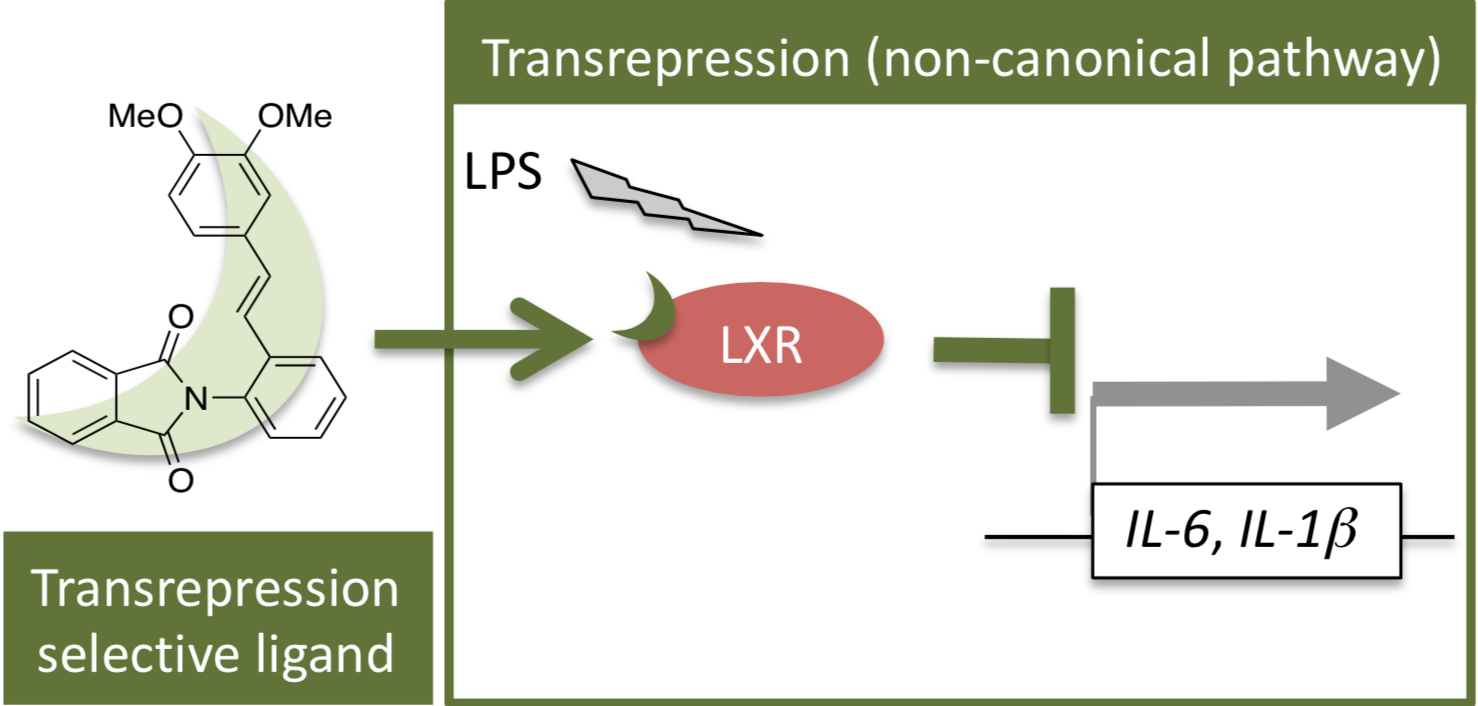
核内受容体リガンドの創製
リガンド依存的な転写因子である核内受容体はヒトでは48種が知られており、様々な生理作用に関与していることから、医薬の標的分子として多大な注目を集めてきました。それ故、種々の核内受容体に対する低分子アゴニスト・アンタゴニストが数多く創製され、幾つかは医薬として活用されています。核内受容体リガンドの作用として、転写因子としての作用を制御する上記の古典的な作用(transactivation)が有名ですが、それに加えて別作用(transrepression)も近年報告されました。transrepressionは、タンパク質間相互作用を介して、リガンド依存的に炎症性サイトカインの転写を抑制する作用です。私達は、これまで報告例が無いtransrepression選択的な肝臓X受容体(LXR)リガンドを創製しました。非古典的作用に選択的なLXRリガンドは、transactivation由来の副作用を軽減した抗炎症薬として期待されます。
J. Med. Chem. 2012, 55, 7360
ACS Med. Chem. Lett. 2015, 6, 902
核内受容体の1種であるビタミンD受容体(VDR)は、活性型ビタミンD3を主要なアゴニストとし、そのアンタゴニストが骨パジェット病治療薬として期待されています。しかし、非セコステロイド型のVDRアンタゴニストは報告がありませんでした。そこで私達は、アンタゴニスト以外のアプローチでVDRの転写活性化を抑制するアプローチが必要と考えました。核内受容体の転写活性化には、アゴニストの結合に加えて核内受容体とコアクチベータータンパク質の結合が必須です。そして、核内受容体がコアクチベーター上のLXXLL配列(L:ロイシン、X:任意のアミノ酸)を認識することが知られています。私達はLXXLL配列を模倣したペプチド等価体を設計・合成することにより、非ペプチド型のVDR阻害物質の創製に成功しました。本化合物は活性は弱いながら、VDRとコアクチベーターの結合を阻害する初めての低分子と言えます。
Bioorg. Med. Chem. Lett. 2010, 20, 1712

システムサポート
そのころわたくしは、モリーオ市の博物局に勤めて居りました。十八等官でしたから役所のなかでも、ずうっと下の方でしたし俸給もほんのわずかでしたが、受持ちが標本の採集や整理で生れ付き好きなことでしたから、わたくしは毎日ずいぶん愉快にはたらきました。殊にそのころ、モリーオ市では競馬場を植物園に拵え直すというので、その景色のいいまわりにアカシヤを植え込んだ広い地面が、切符売場や信号所の建物のついたまま、わたくしどもの役所の方へ

セミナー事業
そのころわたくしは、モリーオ市の博物局に勤めて居りました。十八等官でしたから役所のなかでも、ずうっと下の方でしたし俸給もほんのわずかでしたが、受持ちが標本の採集や整理で生れ付き好きなことでしたから、わたくしは毎日ずいぶん愉快にはたらきました。殊にそのころ、モリーオ市では競馬場を植物園に拵え直すというので、その景色のいいまわりにアカシヤを植え込んだ広い地面が、切符売場や信号所の建物のついたまま、わたくしどもの役所の方へ
お問い合わせ
連絡先(石川): minoru.ishikawa.e4@tohoku.ac.jp