植物生命科学コース

やってみよう Plant Science
植物生命科学コースでは学部3年生になると週に4日または5日実験や実習があり、植物生命科学を実践的に学びます。その様子を紹介します(随時更新) >>コースのページに戻る
2025年6月26日
植物病理学実験を2週にわたって行いました。GFP遺伝子(緑色蛍光タンパク質遺伝子)で標識したキュウリモザイクウイルス(CMV)を植物に接種し、接種葉の初期感染細胞の蛍光顕微鏡観察から始まって、上位葉や根に感染域が拡大するまでの様子を観察しました。後半はウェスタンブロット法によるCMV外被タンパク質の検出を行いました。(宮下)
 暗い部屋で植物に青い光を当てる人々。
暗い部屋で植物に青い光を当てる人々。
 何やら楽しそうです。何をしているかというと・・・
何やら楽しそうです。何をしているかというと・・・
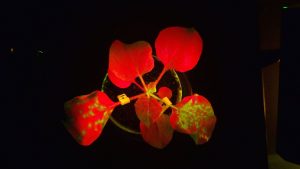 ロングパスフィルタ(> 515 nm、緑~黄~赤の光だけ通す)を通して見ることで、GFP遺伝子で標識したCMVが感染した領域(黄緑の部分)を観察しています。植物の葉は自家蛍光で赤くみえます。写真は接種3日後の様子。下側左右の二枚がCMVを接種した葉で、よく見るとまだ小さい上位葉にCMV感染域が拡がっているのがわかります。
ロングパスフィルタ(> 515 nm、緑~黄~赤の光だけ通す)を通して見ることで、GFP遺伝子で標識したCMVが感染した領域(黄緑の部分)を観察しています。植物の葉は自家蛍光で赤くみえます。写真は接種3日後の様子。下側左右の二枚がCMVを接種した葉で、よく見るとまだ小さい上位葉にCMV感染域が拡がっているのがわかります。
 ウェスタンブロット法では、濾紙・メンブレン(タンパク質を転写する膜)・ゲルをきっちり重ねることが大事です。緊張する作業ですが・・・皆さんリラックスしてますね。
ウェスタンブロット法では、濾紙・メンブレン(タンパク質を転写する膜)・ゲルをきっちり重ねることが大事です。緊張する作業ですが・・・皆さんリラックスしてますね。
 (掲載用に真面目な雰囲気で、とお願いした後の写真)
(掲載用に真面目な雰囲気で、とお願いした後の写真)
また、屋外でアカツメクサのうどんこ病、イネ科雑草のさび病を観察・採集して顕微鏡観察したほか、イネいもち病菌のタマネギ表皮への接種実験、電子顕微鏡を用いてササさび病菌の観察(SEM)、CMV粒子のネガティブ染色による観察(TEM)などを行いました。
 キャンパス内でアカツメクサのうどんこ病の観察。後ろに見えるのは青葉山ユニバーシティハウス(学生宿舎)です。
キャンパス内でアカツメクサのうどんこ病の観察。後ろに見えるのは青葉山ユニバーシティハウス(学生宿舎)です。
 天気が崩れずよかったです。
天気が崩れずよかったです。
 透過型電子顕微鏡(TEM)観察
透過型電子顕微鏡(TEM)観察
 走査型電子顕微鏡(SEM)観察
走査型電子顕微鏡(SEM)観察
 学生がSEMで撮影したササさび病菌の夏胞子堆中の夏胞子。あえて奥の胞子にピントを合わせているのが芸術的ですね。
学生がSEMで撮影したササさび病菌の夏胞子堆中の夏胞子。あえて奥の胞子にピントを合わせているのが芸術的ですね。
2025年6月4日
昆虫学実験でカイコを解剖して、内部形態の観察をしました。(長澤)
 カイコ解剖の様子1
カイコ解剖の様子1
 カイコ解剖の様子2
カイコ解剖の様子2
 解剖したカイコ(編注:平気な方はじっくりご覧ください。絹糸腺があるのがわかります)
解剖したカイコ(編注:平気な方はじっくりご覧ください。絹糸腺があるのがわかります)
2024年12月18日
植物生産学実習 II。9月からスタートし、主に秋冬野菜が対象。必須課題であるアブラナ科野菜やそのほかにホウレンソウなどの自由課題野菜を各自栽培しました。夏野菜とは違ったことが経験できた実習でした。18日は各自料理の持ち寄りで収穫祭を開催し、実習 Iと同じように、アイデア溢れる調理でみんなで美味しくいただきました。お疲れさまでした&ごちそうさまでした。(北柴)
 実習の成果(拡大PDF)
実習の成果(拡大PDF)
2024年10月31日
DNA実験IIでは、DNAクローニングの実習を行いました。イネ遺伝子断片をPCR増幅してプラスミドベクターに挿入し、大腸菌を形質転換しました。得られた大腸菌のコロニーを液体培養してプラスミドを抽出し、サンガー法で挿入断片の塩基配列を決定して確認する、という一連の流れを体験しました。配列解析演習では、blast検索のほか、イネデータベースによる発現パターンの検索、PDBの利用なども学びました。また、Linux/Unix環境での次世代シーケンスデータの解析も演習しました。(宮下)
 DNA抽出中
DNA抽出中
 プラスミドDNA取れたかな?
プラスミドDNA取れたかな?
 AlphaFold開発者が2024年のノーベル化学賞を受賞したことを記念し(?)、植物病理学分野の遠藤君(B4)がAlphaFold3を活用した自身の研究について紹介しました。その後、AlphaFold3利用の演習として、リンゴのβ-ガラクトシダーゼの構造予測を行いました。
AlphaFold開発者が2024年のノーベル化学賞を受賞したことを記念し(?)、植物病理学分野の遠藤君(B4)がAlphaFold3を活用した自身の研究について紹介しました。その後、AlphaFold3利用の演習として、リンゴのβ-ガラクトシダーゼの構造予測を行いました。
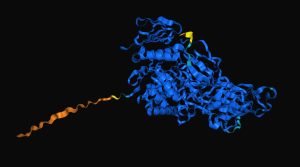 リンゴのβ-ガラクトシダーゼの予測構造。実際には切り離されるシグナルペプチド部分は構造予測が不確かなようです。
リンゴのβ-ガラクトシダーゼの予測構造。実際には切り離されるシグナルペプチド部分は構造予測が不確かなようです。
2024年8月2日
植物生産学実習Ⅰ。4月の耕うん、畝立て、マルチ張り、から始まり、定植、播種、支柱立て(図1)を学び、5月の低温障害を克服するも、病害、生理障害、害虫に悩まされ(図2)、それでも、ヨトウ、アブラムシ、ウリハムシ、オオタバコガ、アワノメイガ、うどんこ病を実際目にして対策を勉強し、まめに除草管理をしてようやく収穫期を迎えることができた(図3)、と思えば鳥害にも遭い、それでも報告会(6、7月)を通してお互いに情報交換しながら負けじと精一杯手をかけた野菜を、アイデア溢れる調理でみんなで楽しく、美味しくいただきました(8月2日、図4)。ごちそうさまでした。(北柴)
 図1
図1
 図2
図2
 図3
図3
 図4
図4
2024年4月30日
植物病理学実験ではウエスタンブロットによってキュウリモザイクウイルスの感染を検出しました。(安藤)
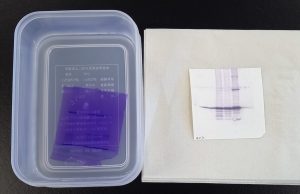 タンパク質の電気泳動の結果(CBB染色)とウエスタンブロットの結果
タンパク質の電気泳動の結果(CBB染色)とウエスタンブロットの結果
 結果について議論中?
結果について議論中?
2024年4月30日
作物生態学実験では層別刈取りを行いました。曇天で風が弱く、層別刈取り日和でした。(中嶋)
 相対照度の測定
相対照度の測定
 相対照度の測定と層別刈り取り
相対照度の測定と層別刈り取り
2024年4月11日
生理学実験では、野菜やイネの種子発芽に及ぼす内的・外的要因について考察します。この際、種子の選抜方法などについても学習します。また、形態学実験では花の形態観察を行います。(西山)
 イネ種子を塩水にいれて、沈んだ種子を充実していると見なして実験に使います。
イネ種子を塩水にいれて、沈んだ種子を充実していると見なして実験に使います。
 花の形態観察。
花の形態観察。
2023年12月18日
有機成分分析実験では、リンゴの果実に含まれる有機成分(糖、有機酸、アミノ酸)を抽出し、定量する方法を学習しました。(西山)
 還元糖の定量実験中。
還元糖の定量実験中。
 サンプルをブロックヒーターで加熱しているところ。サンプルに含まれる主な還元糖(グルコース、フルクトース)によって銅試薬(フェーリング液)に含まれる銅イオンが還元されます。
サンプルをブロックヒーターで加熱しているところ。サンプルに含まれる主な還元糖(グルコース、フルクトース)によって銅試薬(フェーリング液)に含まれる銅イオンが還元されます。
 アミノ酸の定量実験。ニンヒドリン反応を利用しています。
アミノ酸の定量実験。ニンヒドリン反応を利用しています。
 恒例の年末の大掃除中。
恒例の年末の大掃除中。
2023年11月20日
RNA実験ではRT-PCR法によってコメの培養細胞(カルス)が植物ホルモンによってどのような遺伝子応答が起こるのかを調べました。植物ホルモン処理、RNA抽出、逆転写反応、RT-PCRなどの実習を行い、植物分子遺伝学の基礎的解析手法であるRNAの取り扱いについて学びました。(五十嵐)
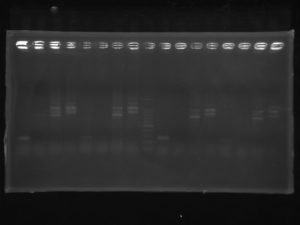 カルスの植物ホルモンに対する遺伝子応答を検出したRT-PCR実験の泳動写真
カルスの植物ホルモンに対する遺伝子応答を検出したRT-PCR実験の泳動写真
2023年11月1日
DNA実験IIの後半は、次世代シーケンスデータの解析演習をしました。Windows PCにWSL2で導入したLinux環境にMiniconda3を使ってseqkit, fastqc, kallisto, SPAdesなどをインストールして解析を行い、次世代シーケンサのデータ形式、RNA-seq、de novo assembleを実践的に学びました。また希望者を対象に、サンガーシーケンサとイルミナシーケンサMiSeqの見学会を実施しました。(宮下)
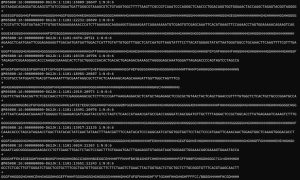 fastq形式のデータ。RNA-seq解析では演習用に1万リードに減らしたデータを解析しました。とはいえ、4万行のファイルなので普段の生活で扱うデータよりずっと多いですね。
fastq形式のデータ。RNA-seq解析では演習用に1万リードに減らしたデータを解析しました。とはいえ、4万行のファイルなので普段の生活で扱うデータよりずっと多いですね。
 サンガーシーケンサーのキャピラリー。よく見ると読み取り部は細いガラス管でできているのが分かります。
サンガーシーケンサーのキャピラリー。よく見ると読み取り部は細いガラス管でできているのが分かります。
 イルミナシーケンサMiSeqのフローセル。こちらはガラス基板上でPCRと読み取りの両方が行われます。
イルミナシーケンサMiSeqのフローセル。こちらはガラス基板上でPCRと読み取りの両方が行われます。
 今年も作物学研究室のメンバーがハロウィンのカボチャを作ったようです。年々クオリティが上がっています(笑)
今年も作物学研究室のメンバーがハロウィンのカボチャを作ったようです。年々クオリティが上がっています(笑)
2023年10月24日
DNA実験IIの前半は、DNAクローニングの実習を行いました。イネ葉身から抽出したゲノムDNAを鋳型としてイネ遺伝子断片をPCR増幅し、TAクローニング用ベクターとライゲーションして大腸菌を形質転換しました。コロニーPCRとミニプレップ+制限酵素処理の両方で断片の挿入を確認し、サンガー法による挿入断片配列の決定を行いました。この配列をblastn等でデータベース検索したほか、blastp検索やPDBでタンパク質構造を見る演習も行いました。(宮下)
 DNAクローニングの実習の様子。博士前期課程所属のTAも参加して丁寧に教えてくれます。
DNAクローニングの実習の様子。博士前期課程所属のTAも参加して丁寧に教えてくれます。
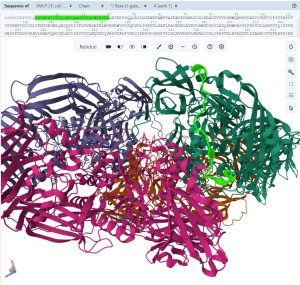 LacZタンパク質の立体構造(黄緑色はαペプチド領域)。
LacZタンパク質の立体構造(黄緑色はαペプチド領域)。
2023年6月21日
植物病理学実験で電子顕微鏡(SEM)を使って植物病原細菌の観察を行いました。(安藤)
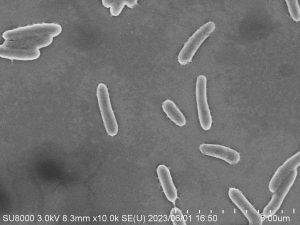 バクテリア(Pseudomonas syringae pv. tabaci)の電顕写真
バクテリア(Pseudomonas syringae pv. tabaci)の電顕写真
2023年6月14日
DNA実験ⅠでPCR法によるコメ(ササニシキとひとめぼれの2品種)の品種判別を行いました。DNAの抽出方法、PCR法、電気泳動による確認の実習を行い、植物分子遺伝学の基礎的解析手法であるDNAの取り扱いについて学びました。(五十嵐)
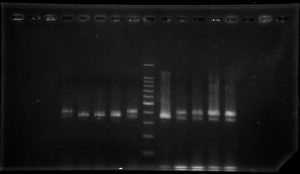 ササニシキとひとめぼれを用いたPCR実験の泳動写真
ササニシキとひとめぼれを用いたPCR実験の泳動写真
2023年6月1日
昆虫学実験でコバネイナゴのスケッチを行い、昆虫の形態を学びました。(長澤)
 コバネイナゴのスケッチの様子
コバネイナゴのスケッチの様子
2023年5月24日
昆虫学実験で昆虫採集を行いました。青葉の森緑地で班ごとに採集を行いました。(長澤)
 昆虫採集の様子
昆虫採集の様子
 捕らえたスズメバチ
捕らえたスズメバチ
2023年4月27日
作物生態学実験では、イネ科植物の形態観察と層別刈取法により作物群落の生産構造図作成を行います。今年は学生自身でImageJを用いて葉面積を測定しました。(中嶋)
 層別刈取りの様子
層別刈取りの様子
 葉面積測定の一部
葉面積測定の一部
2023年4月24日
生理学実験では、野菜やイネの種子を供試して発芽の内的・外的要因について考察します。イネについては、発芽に関わる酵素であるα-アミラーゼの活性も測定します。これらの実験で得られたデータを統計処理するための演習も同時期に行われます。また、形態学実験では、第3セメスターに行われる観賞園芸学の事前学習として花の形態観察を行います。(西山)
 α-アミラーゼの活性測定。3年生に進級して初めての実験で、実験器具の使用法も学習します。
α-アミラーゼの活性測定。3年生に進級して初めての実験で、実験器具の使用法も学習します。
 発芽実験。温湯処理やジベレリン処理などをした種子をインキュベータ内で発芽させます。
発芽実験。温湯処理やジベレリン処理などをした種子をインキュベータ内で発芽させます。
 花の形態観察
花の形態観察
2023年1月30日
土壌分析実験を行いました。土壌は粘土や砂、微生物などが混ざっている複合体です。いろいろな方法で抽出や分画を行うことで、その土壌がもつ性質を知ることができます。(濱本)
 分析は土壌を均一にしていく必要があります。大きな塊を潰したり、根などを除去します。
分析は土壌を均一にしていく必要があります。大きな塊を潰したり、根などを除去します。
 土壌に含まれる有機物を過酸化水素で分解しました。泡が溢れてしまいました。
土壌に含まれる有機物を過酸化水素で分解しました。泡が溢れてしまいました。
 土壌にはアンモニアから硝酸に変換する(硝化)微生物がいます。異なる土壌でその硝化能力がどれくらい違うのか、を調べました。
土壌にはアンモニアから硝酸に変換する(硝化)微生物がいます。異なる土壌でその硝化能力がどれくらい違うのか、を調べました。
2022年12月16日
有機成分分析実験では、リンゴの果実に含まれる有機成分(糖、デンプン、有機酸、アミノ酸)の定量を行いました。高校の化学で学習する反応を応用することもあります。(西山)
 ソモギー・ネルソン法(フェーリング反応)による全糖の定量。この実験では、非還元糖(スクロース)に塩酸を加えて加熱して還元糖(グルコース、フルクトース)に加水分解します。写真は加水分解後の中和を行っています。糖分析は、高速液体クロマトグラフィー(HPLC)でも行いました。
ソモギー・ネルソン法(フェーリング反応)による全糖の定量。この実験では、非還元糖(スクロース)に塩酸を加えて加熱して還元糖(グルコース、フルクトース)に加水分解します。写真は加水分解後の中和を行っています。糖分析は、高速液体クロマトグラフィー(HPLC)でも行いました。
 ニンヒドリン反応を利用したアミノ酸の定量。グルタミン酸の濃度によって色の濃さが異なります。
ニンヒドリン反応を利用したアミノ酸の定量。グルタミン酸の濃度によって色の濃さが異なります。
 分光光度計で吸光度を測定して検量線を作り、リンゴに含まれるアミノ酸の定量を行います。
分光光度計で吸光度を測定して検量線を作り、リンゴに含まれるアミノ酸の定量を行います。
2022年11月30日
組織培養実験では、タバコを材料にアグロバクテリウムを用いた葉片感染で遺伝子組換え植物を作りました。10月に感染操作を行い、11月下旬まで約2週間ごとに新しい培地に移植する操作を行いました。その後、各学生が作った遺伝子組換え植物を材料に、PCRとGUS染色法で目的の遺伝子が導入されているか確認を行いました。植物の遺伝子組換え実験の一連の操作を学びました。(山本)
 作製した遺伝子組換え植物の葉からDNAを抽出している様子。頑張って葉っぱを潰しています。
作製した遺伝子組換え植物の葉からDNAを抽出している様子。頑張って葉っぱを潰しています。
 GUS染色を行うため、葉を回収している様子。クリーンベンチを利用して無菌で操作を行っています。
GUS染色を行うため、葉を回収している様子。クリーンベンチを利用して無菌で操作を行っています。
2022年11月1日
DNA実験IIの後半は、次世代シーケンスデータの解析演習です。Windows PCの学生はWSL2でLinux環境を導入し、Macの学生はターミナル(UNIX環境)で次世代シーケンサのデータ形式、RNA-seq、de novo assembleのエッセンスを実践を通して学びました。また、de novo assembleで得られた複数コンティグをまとめてblast検索しました。(宮下)


 RNA-seqの結果について、グループごとに議論しています。どこまでが確率的なばらつきでどこからが実験条件に依存した「本当に知りたい違い」か、統計学的な考え方で検討しました。
RNA-seqの結果について、グループごとに議論しています。どこまでが確率的なばらつきでどこからが実験条件に依存した「本当に知りたい違い」か、統計学的な考え方で検討しました。
 ところで昨日はハロウィンでした。植物コースの学生有志が大きなカボチャを栽培・加工して農学部の玄関前に飾っています。
ところで昨日はハロウィンでした。植物コースの学生有志が大きなカボチャを栽培・加工して農学部の玄関前に飾っています。
2022年10月20日
DNA実験IIでは、DNAクローニングの実習を行いました。まずイネ遺伝子断片をPCR増幅してプラスミドベクターに挿入し、大腸菌を形質転換しました。選択培地上に得られた大腸菌のコロニーを培養してプラスミドを抽出し、サンガー法で挿入断片の塩基配列を決定してblast検索を行う、という一連の流れを体験しました。(宮下)
 イネゲノムDNAの抽出操作。イネの葉をバッファー(緩衝液)中ですりつぶし、フェノールクロロホルム精製しています。
イネゲノムDNAの抽出操作。イネの葉をバッファー(緩衝液)中ですりつぶし、フェノールクロロホルム精製しています。
 イネゲノムDNAの観察。無事に抽出できたようです。
イネゲノムDNAの観察。無事に抽出できたようです。
 プラスミドDNAの抽出。ピペットマンを使う作業は集中して真剣な表情です。
プラスミドDNAの抽出。ピペットマンを使う作業は集中して真剣な表情です。
2022年10月12日
酵素学実験ではリンゴの果実から、成熟果実の軟化時に細胞壁に結合して細胞壁多糖類中のガラクトーストを末端から遊離させて軟化に関与するβーガラクトシダーゼの活性を測定しました。(加藤)
 すり下ろした果肉から抽出
すり下ろした果肉から抽出
 酵素活性を測定するために37度に設定したウオーターバスに反応液と酵素液を混ぜて酵素反応させています。
酵素活性を測定するために37度に設定したウオーターバスに反応液と酵素液を混ぜて酵素反応させています。
 分光光度計を用いて、酵素反応で変化した吸光度を測定して、酵素活性を求めます。
分光光度計を用いて、酵素反応で変化した吸光度を測定して、酵素活性を求めます。
2022年9月30日
川渡フィールドセンターにて、土壌断面の観察や腐植層の厚さ調査などの実習を行いました(農場実習A)。(濱本)
 実習中は天気に恵まれました。
実習中は天気に恵まれました。
 掘った穴の観察は土壌の成り立ちを理解する上で役立ちます。
掘った穴の観察は土壌の成り立ちを理解する上で役立ちます。
2022年6月29日
植物病理学実験では、植物病原体の植物への接種や、病徴の観察、病原体の検出を行います。キュウリモザイクウイルス(CMV)を接種したタバコ(Nicotiana benthamiana)からタンパク質を抽出し、電気泳動(SDS-PAGE)後、抗体反応を用いてウイルスタンパク質の検出を行いました。また、電子顕微鏡を用いてササさび病菌の冬胞子の観察を行いました。(安藤)
 タンパク質の電気泳動の様子
タンパク質の電気泳動の様子
 CMVを接種したタバコ(左:健全、右:感染)
CMVを接種したタバコ(左:健全、右:感染)
 ササさび病菌の冬胞子の電子顕微鏡写真
ササさび病菌の冬胞子の電子顕微鏡写真
2022年6月15日
DNA実験Iでは、PCRを用いたイネの品種判別を行いました。ササニシキとひとめぼれの米粒1つからDNAを抽出し、両品種で多型が見られるマイクロサテライトマーカーをPCRで増幅し、アガロースゲル電気泳動を行いました。品種によりDNA配列が異なること、それを利用して品種判別が可能なこと、そして分子生物学的実験手法を学びました。(伊藤)
 アガロースゲル電気泳動
アガロースゲル電気泳動
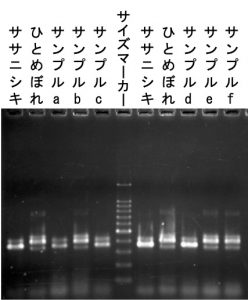 ゲルの写真
ゲルの写真
2022年5月24日
昆虫学実験で、昆虫採集を行いました。農学部に近い青葉の森緑地に行き、班ごとに分かれて採集し、翌日、同定しながら、標本を作りました。(長澤)
 昆虫採集の様子1
昆虫採集の様子1
 昆虫採集の様子2
昆虫採集の様子2
 標本作製
標本作製
2022年5月18日
分子遺伝学実験では、担当の植物遺伝育種学分野が精力的に研究していますアブラナ科植物の自家不和合性を題材に実習を行い、形質と遺伝子型の関係を学びます。(山本)
 交配花のサンプリング
交配花のサンプリング
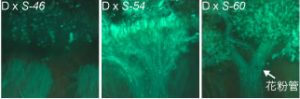 柱頭上での花粉の発芽の様子
柱頭上での花粉の発芽の様子
2022年5月17日
作物生態学実験では、イネ科植物の形態観察と層別刈取法により作物群落の生産構造図作成を行います。(中嶋)
 イネ苗の観察
イネ苗の観察
 イネ科の穂の観察
イネ科の穂の観察
 層別刈取りの様子
層別刈取りの様子
2022年5月13日
生産フィールド実習1では手で水稲苗移植をおこないます。(田島)
 水稲苗移植
水稲苗移植
2022年4月21日
種子発芽実験で発芽調査を行っています。この実験では、野菜やイネを材料として播種の方法を実習し、発芽の内的・外的要因について考察します。また、同じ時期に統計処理演習を行い、種子発芽実験で得られた結果をもとに実践的な統計解析を学習します。(西山)
 発芽調査
発芽調査
 イネの発芽
イネの発芽



