アルツハイマー病の原因となる毒性アミロイドの生成を抑制する予防変異を同定した
アルツハイマー病では、毒性アミロイドペプチド(Aβ)の凝集体が脳内に蓄積して、神経細胞死を引き起こします。Aβは38〜43アミノ酸からなり、γセクレターゼというプロテアーゼ(タンパク質分解酵素)がアミロイド前駆体ペプチドを切断することで生じ、特に長鎖Aβ42とAβ43はアミロイドのコアとなる分子で、毒性が高く発症に直結します。家族性アルツハイマー病(FAD)では、アミロイド前駆体(APP)遺伝子変異によって切断が異常になり、毒性の高いAβ42とAβ43が生成しますが、そのメカニズムは不明でした。
東北大学農学研究科酵素化学分野の二井勇人准教授、鈴木涼太さん(修士2年)、小川智久教授、日高將文助教らの研究グループは、酵母を用いた研究により、FAD変異の切断異常を回復させるサプレッサー変異(予防変異)を特定しました。酵母の結果は哺乳類細胞(CHO, チャイニーズハムスター卵巣細胞)を用いて確認され、細胞が分泌する毒性アミロイドAβ42とAβ43の産生が大きく抑制されました。今回同定した変異は、膜貫通領域内にプロリンを導入するもので、アミロイド前駆体タンパク質の二次構造の不安定化により、切断が促進されたと考えられます。毒性Aβの生成を減少させる化合物(γセクレターゼモジュレーター)は世界中で探索されており、今回の鈴木らの研究成果はアルツハイマー病治療薬の探索と開発応用へ結びつくものとして大いに期待されます。
本研究成果は、2023年2月16日に科学雑誌「International Journal of Molecular Sciences」に掲載されました。
 写真1:Aβの生成機構
写真1:Aβの生成機構
アミロイド前駆体タンパク質(APP)がγセクレターゼにより段階的な切断を受けることで、長さの異なるAβが生成する。家族性アルツハイマー病変異では、短いAβを生成するトリミング切断に異常が出ることでAβ42とAβ43を蓄積するようになる。
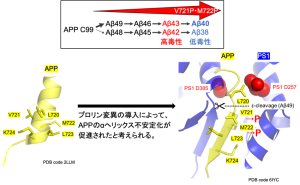 写真2:APP変異によるAβ生成機構の変化
写真2:APP変異によるAβ生成機構の変化
APP の膜貫通領域にプロリンを導入した変異(V721P, M722P)によりトリミングが促進され、短いAβ38とAβ40の割合が増加することが分かった。APPの膜貫通ヘリックス(左図,PDB code 2LLM)と、切断時の複合体構造(右図,PDB code 6IYC)中でのプロリン変異の位置を示した。
【論文情報】
Ryota Suzuki, Haruka Takahashi, Chika Yoshida, Masafumi Hidaka, Tomohisa Ogawa*, Eugene Futai*, Specific Mutations near the Amyloid Precursor Protein Cleavage Site Increase γ-Secretase Sensitivity and Modulate Amyloid-β Production. Published on February 16, 2023, doi//10.3390/ijms24043970 (*corresponding author)
東北大学大学院農学研究科 酵素化学分野
研究室ホームページ:https://www.agri.tohoku.ac.jp/enzyme/index-j.html (論文で用いている酵母のスクリーニング系の詳細と、論文へのリンクがあります。)
- 3.すべての人に健康と福祉を




